Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Выше (§ 39) уже говорилось, что образование ковалентной связи является результатом перекрывания валентных электронных облаков взаимодействующих атомов. Но такое перекрывание возможно только при определенной взаимной ориентации электронных облаков; при этом область перекрывания располагается в определенном направлении по отношению к взаимодействующим атомам. Иначе говоря, ковалентная связь обладает направленностью.
Так, в молекуле водорода (рис. 27) перекрывание атомных s-электронных облаков происходит вблизи прямой, соединяющей ядра взаимодействующих атомов (т.е. вблизи оси связи). Образованная подобным образом ковалентная связь называется σ-связью (сигма — связь).
В образовании σ-связи могут принимать участие и р-электронные облака, ориентированные вдоль оси связи. Так, в молекуле HF (рис. 32) ковалентная σ-связь возникает вследствие перекрывания 1s-электронного облака атома водорода и 2p-электронного облака атома фтора. Химическая связь в молекуле F 2(рис. 33) — тоже σ-связь; она образована 2р-электронными облаками двух атомов фтора.
При взаимодействии р-электроннх облаков, ориентированных перпендикулярно оси связи (рис. 34), образуется не одна, а две области перекрывания, расположенные по обе стороны от этой оси. Такая ковалентная связь называется π-связью (пи-связь).
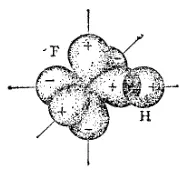
Рис. 32. Схема перекрывания 2p-электронного облака атома фтора и 1s-электронного облака атома водорода при образовании σ-связи в молекуле HF
+ и — знаки волновой функции.
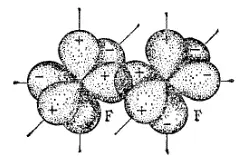
Рис. 33. Схема перекрывания 2р-электронных облаков атомов фтора при образовании σ-связи в молекуле F 2.
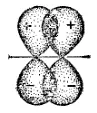
Рис. 34. Схема перекрывания р-электронных облаков при образовании π-связи.
- 128 -
Рассмотрим образование молекулы азота N 2. Каждый атом азота обладает тремя неспаренными 2р-электронами, электронные облака которых ориентированы в трех взаимно перпендикулярных направлениях.
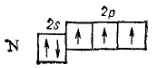
На рис. 35 изображено перекрывание р-электронных облаков в молекуле N 2(для удобства изображения перекрывание p x- p y- p z-облаков показано раздельно). Как показывает рис. 35, атомы азота связаны в молекуле N 2тремя ковалентными связями. Но эти связи неравноценны: одна из них σ-связь, а две другие π-связи. Вывод о неравноценности связей в молекуле азота подтверждается тем, что энергия их разрыва различна.
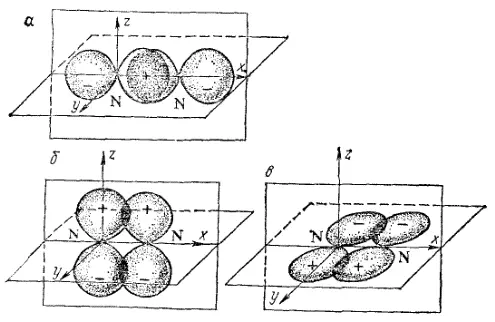
Рис. 35. Схема перекрывания 2р-электронных облаков в молекуле N 2;
а - σ-связь; б и в — π-связи.
Представление о направленности ковалентных связей позволяет объяснить взаимное расположение атомов в многоатомных молекулах. Так, при образовании молекулы воды электронные облака двух неспаренных 2р-электронов атома кислорода; перекрываются с 1s-электроными облаками двух атомов водорода; схема этого перекрывания изображена на рис. 36. Поскольку р-электронные облака атома кислорода ориентированы во взаимно перпендикулярных направлениях, то молекула H 2O имеет, как показано на рис. 36, угловое строение, причем можно ожидать, что угол между связями O-H будет составлять 90˚.
Молекула NH 3, образующаяся при взаимодействии трех р-электронов атома азота с s-электронами трех атомов водорода (рис. 37), имеет структуру пирамиды, в вершине которой находится атом азота, а в вершинах основания атомы водорода. И в этом случае можно ожидать, что углы между связями N-H будут равны 90˚.
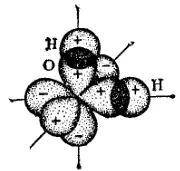
Рис. 36. Схема образования химических связей в молекуле воды.
- 129 -
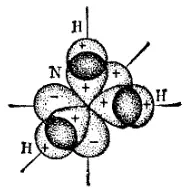
Рис. 37. Схема образования химических связей в молекуле аммиака.
Эти выводы о взаимном расположении атомов в молекулах NH 3и H 2O соответствуют действительности. Значительная полярность молекул воды (μ =1,84 D) и аммиака (μ =1,48 D), а также данные структурных исследований свидетельствуют о том, что молекула H 2O имеет угловое строение, а молекула NH 3построена в форме пирамиды. Однако углы между связями (валентные углы) отличаются от 90˚: в молекуле воды угол HOH составляет 104,5˚, а в молекуле аммиака угол HNH равен 107,3˚.
Для объяснения отличия валентных углов в молекулах H 2O и NH 3от 90˚ следует принять во внимание, что устойчивому состоянию молекулы отвечает такая ее геометрическая структура и такое пространственное расположение электронных облаков внешних оболочек атомов, которым отвечает наименьшая потенциальная энергия молекулы. Это приводит к тому, что при образовании молекулы формы и взаимное расположение атомных электронных облаков изменяются по сравнению с их формами и взаимным расположением в свободных атомах. В результате достигается более полное перекрывание валентных электронных облаков и, следовательно, образование более прочных ковалентных связей. В рамках метода валентных связей такая перестройка электронной структуры атома рассматривается на основе представления о гибридизации атомных орбиталей.
43. Гибридизация атомных электронных орбиталей.
Метод гибридизации атомных орбиталей исходит из предположения, что при образовании молекулы вместо исходных атомных s-, p- и d-электронных облаков образуются такие равноценные «смешанные» или гибридныеэлектронные облака, которые вытянуты по направлению к соседним атомам, благодаря чему достигается их более полное перекрывание с электронными облаками этих атомов. Такая деформация электронных облаков требует затраты энергии. Но более полное перекрывание валентных электронных облаков приводит к образованию более прочной химической связи и, следовательно, к дополнительному выигрышу энергии. Если этот выигрыш энергии достаточен, чтобы с избытком скомпенсировать затраты энергии на деформацию исходных атомных электронных облаков, такая гибридизация приводит, в конечном счете, к уменьшению потенциальной энергии образующейся молекулы и, следовательно, к повышению ее устойчивости.
- 130 -
Рассмотрим в качестве примера гибридизации образование молекулы фторида бериллия BeF 2. Каждый атом фтора, входящий в состав этой молекулы, обладает одним неспаренным электроном,
Читать дальшеИнтервал:
Закладка:








