Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Как показывают рис. 39, 41 и 42, гибридные электронные облака смещены относительно ядра атома.
- 133 -
Поэтому центр электрического заряда неподеленной электронной пары, находящейся на гибридной орбитали, не совпадает с положением атомного ядра, т. е. с центром имеющегося в атоме положительного заряда. Такое смещение заряда неподеленной электронной пары приводит к появлению дипольного момента, вносящего существенный вклад в суммарный дипольный момент молекулы. Из этого следует, что полярность молекулы зависит не только от полярности отдельных связей и их взаимного расположения (см. § 40), но и от наличия неподеленных электронных пар на гибридных орбиталях и от пространственного расположения этих орбиталей.
У элементов третьего и последующих периодов в образований гибридных электронных облаков могут участвовать и d-орбитали. Особенно важен случай sp 3d 2-гибридизации, когда в образовании гибридных орбиталей участвуют одна s-, три p- и две d-орбитали. В этом случае образуются шесть равноценных гибридных орбиталей, вытянутых в направлениях к вершинам октаэдра. Октаэдрическая структура молекулы SF 6, ионов [SiF 6] 2-, [Fe(CN 6)] 3-и многих других объясняется sp 3d 2-гибридизацией атомных орбиталей центрального атома.
44. Многоцентровые связи.
По мере развития метода валентных связей выяснилось, что в некоторых случаях любая из возможных для данной молекулы валентных схем плохо согласуется с установленными на опыте свойствами этой молекулы: истинные свойства молекулы оказываются промежуточными между теми, которые приписываются ей каждой отдельной схемой. В подобных случаях структуру молекулы можно выразить набором из нескольких валентных схем. Такой способ описания молекул получил название метода наложения валентных схем.
Рассмотрим, например, электронную структуру молекулы азотной кислоты HNO 3. В этой молекуле атом водорода связан с атомом кислорода ковалентной связью:
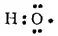
Атом кислорода за счет оставшегося у него неспаренного электрона образует ковалентную связь с атомом азота:
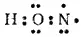
В свою очередь, два неспаренных электрона атома азота участвуют в образовании двух ковалентных связей со вторым атомом кислорода:
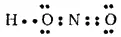
Мы видим, что у атома азота сохранилась неподеленная пара электронов, так что здесь азот, выступая в качестве донора электронной пары, способен образовать еще одну ковалентную связь по донорно-акцепторному способу. В молекуле HNO 3акцептором электронной пары атома азота является третий атом кислорода, переходящий в возбужденное состояние, в котором он обладает одной свободной 2p-орбиталью*;
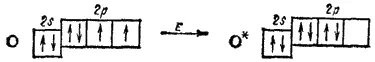
* В данном случае возбуждение атома выражается не в распаривании электронов, как это имело место в рассмотренных раньше случаях (см. § 41), а в переходе неспаренного электрона на орбиталь, занятую другим неспаренным электроном. Такой переход требует затраты энергии, напомним, что правило Хунда (см. § 32) не запрещает подобных возбужденных состояний, а лишь указывает на их меньшую устойчивость по сравнению с основным (невозбужденным) состоянием атома.
- 134 -
Таким образом, получаем следующую валентную схему молекулы азотной кислоты:
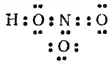
или
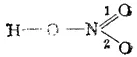
Согласно последней схеме (в которой цифрами занумерованы связи азот-кислород), связи 1 и 2 в молекуле HNO 3неодинаковы: связь 1 - двойная, а связь 2 — простая. В действительности же эти связи во всех отношениях (энергия связи, межъядерные расстояния N—О и т. д.) равноценны. Это означает, что структуру молекулы HNO 3можно с равным основанием описать аналогичной валентной схемой:
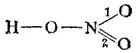
Каждая из валентных схем (I) и (II) неточно описывает строение и свойства молекулы азотной кислоты: истинная структура этой молекулы является промежуточной между схемами (I) и (II) и может рассматриваться как результат сочетания (или наложения) этих валентных схем.
Из сказанного не следует, что азотная кислота может реально существовать в двух различных формах (I) и (II): описание молекулы HNO 3с помощью набора валентных схем означает только, что каждая из этих схем в отдельности не соответствует истинной электронной структуре молекулы.
Распределение электронов в молекуле азотной кислоты можно более точно передать следующей схемой:
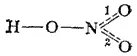
Здесь пунктирные линии означают, что одна из общих электронных пар не принадлежит целиком ни связи 1 (схема I), ни связи 2 (схема II), по в равной степени распределена между этими связями. Иначе говоря, эта электронная пара принадлежит не двум, а трем атомам — атому азота и двум атомам кислорода; образованная eю связь является, следовательно, не двухцентровой, а трехцентровой.
Электронная структура иона CO 3 2-может быть представлена тремя валентными схемами
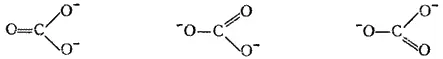
каждая из которых указывает на неравноценность связей углерод — кислород. Такой вывод не соответствует действительности: все три связи C-O в ионе CO 3 2-равноценны.
- 135 -
Истинное строение этого иона может рассматриваться как результат наложения всех трех приведенных валентных схем, т. е. может быть представлено в следующей форме:
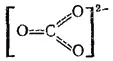
Здесь, как и раньше, пунктирные линии означают, что одна из общих электронных пар в равной степени распределена между всеми тремя связями C-O. Эта электронная пара принадлежит всем четырем атомам, входящим в состав иона CO 3 2-; образованная ею ковалентная связь — четырехцентровая.
Примерами молекул с многоцентровыми связями могут служить также молекулы бензола (стр. 462) и диборана (стр. 612).
Как указывалось в § 39, одно из положений метода ВС заключается в том, что все химические связи являются двухцентровыми. Однако на самом деле, как показывают рассмотренные выше примеры, в ряде случаев правильнее считать двухэлектронные связи многоцентровыми.
45. Метод молекулярных орбиталей.
Как было показано в предыдущих параграфах, метод ВС позволяет понять способность атомов к образованию определенного числа ковалентных связей, объясняет направленность ковалентной связи, дает удовлетворительное описание структуры и свойств большого числа молекул. Однако в ряде случаев метод ВС не может объяснить природу образующихся химических связей или приводит к неверным заключениям о свойствах молекул.
Читать дальшеИнтервал:
Закладка:








