Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Рис. 50. Энергетическая схема образования МО при взаимодействии 2p-орбиталей двух одинаковых атомов.
Таким образом, число связывающих электронов здесь на единицу больше числа разрыхляющих. Следовательно, ион H 2 +должен быть энергетически устойчивым. Действительно, существование иона H 2 +экспериментально подтверждено и установлено, что при его образовании выделяется энергия;
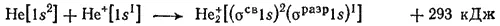
Напротив, гипотетическая молекула He 2должна быть энергетически неустойчивой, поскольку здесь из четырех электронов, которые должны разместиться на МО, два займут связывающую, а два — разрыхляющую МО. Следовательно, образование молекулы He 2не будет сопровождаться выделением энергии. Действительно, молекулы He 2экспериментально не обнаружены.
В молекулах элементов второго периода МО образуются в результате взаимодействия атомных 2s и 2p-орбиталей; участие внутренних 1s-электронов в образовании химической связи здесь пренебрежимо мало. Так, на рис. 49 приведена энергетическая схема образования молекулы Li 2: здесь имеются два связывающих электрона, что соответствует образованию простой связи. В молекуле же Be 2число связывающих и разрыхляющих электронов одинаково, так что эта молекула, подобно молекуле He 2, энергетически неустойчива. Действительно, молекул Be 2обнаружить не удалось.
Схема образования МО при взаимодействии атомных 2p-орбиталей показана на рис. 50. Как видно, из шести исходных 2p-орбиталей образуются шесть МО: три связывающих и три разрыхляющих. При этом одна связывающая ( σ св2p) и одна разрыхляющая σ разр2p орбитали принадлежат к σ-типу: они образованы взаимодействием атомных 2p-орбиталей, ориентированных вдоль оси связи. Две связывающие (π св2p) и две разрыхляющие (π разр2p) орбитали образованы взаимодействием 2p-орбиталей, ориентировванных перпендикулярно оси связи; эти орбитали принадлежат к π-типу.
- 142 -
На рис. 51 представлена схема заполнения МО в молекуле азота N 2. Здесь на МО должны разместиться шесть 2p-электронов обоих атомов азота. Они заполняют три связывающие МО, а все разрыхляющие МО остаются незанятыми. Общее число связывающих электронов в молекуле N 2равно шести, что соответствует образованию тройной связи.
В молекуле кислорода O 2(рис. 52) в образовании химических связей принимают участие по четыре 2p-электрона каждого атома; всего, следовательно, на МО должны перейти восемь электронов. Шесть из них занимают три связывающие МО, а два размещаются на разрыхляющих молекулярных орбиталях π разр2p; здесь избыток числа связывающих электронов над числом разрыхляющих равен четырем, а кратность связи — двум. Обе орбитали π разр2p энергетически равноценны, и электроны должны размещаться здесь в соответствии с правилом Хунда (см. § 32), которое сохраняет свою справедливость и в приложении к молекулам. Поэтому каждая из орбиталей π разр2p занимается одним электроном и притом так, что спины этих электронов имеют одинаковое направление. Из схемы на рис. 52 вытекает, что в молекуле O 2имеются два неспаренных электрона, вследствие чего эта молекула должна быть парамагнитной. Как указывалось выше, это подтверждается на опыте. Таким образом, метод МО объясняет магнитные свойства молекулярного кислорода.
При образовании иона O 2 +из молекулы O 2удаляется электрон, обладающий максимальной энергией, т. е. находящийся на разрыхляющей молекулярной орбитали π разр2p. Уменьшение числа разрыхляющих электронов приводит к повышению кратности связи (число связывающих электронов становится больше числа разрыхляющих уже не на четыре, а на пять) и, следовательно, к образованию более прочной молекулы.
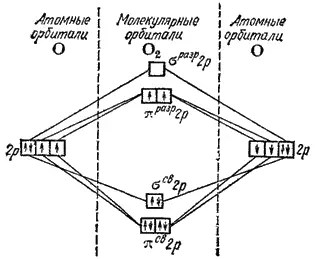
Рис. 51. Энергетическая схема образования молекулы азота N 2.
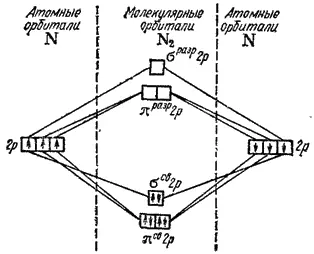
Рис. 52. Энергетическая схема образования молекулы кислорода O 2.
- 143 -
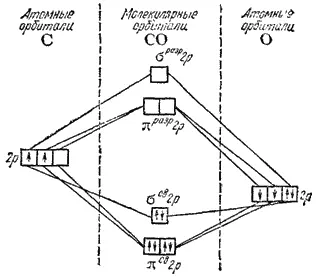
Рис. 53. Энергетическая схема образования молекулы оксида углерода СО.
Именно поэтому энергия диссоциации молекулярного иона O 2 +выше, чем энергия диссоциации молекулы O 2(см. стр. 136).
Подобным же образом рассматривается с точки зрения метода МО образованне молекул, состоящих из различных атомов. Так, на рис. 53 представлена энергетическая схема образования молекулы оксида углерода СО. Здесь на МО переходят четыре 2p-электрона атома кислорода и два 2p-электрона атома углерода. Энергия 2p-электроиов соединяющихся атомов неодинакова: заряд ядра атома кислорода выше, чем заряд ядра атома углерода, так что 2p-электроны в атоме кислорода сильнее притягиваются ядром. Поэтому на рис. 53 расположение 2p-орбиталей атома кислорода соответствует более низкой энергии в сравнении с 2p-орбиталями атома углерода. Как показывает схема, все шесть электронов, участвующих в образовании связи, размещаются на трех связывающих МО.
Наличие в молекуле СО шести связывающих электронов при отсутствии разрыхляющих электронов отвечает, как и в молекуле азота (рис. 51), образованию тройной связи. Это объясняет значительное сходство в свойствах свободного азота и оксида углерода, например, близость энергии диссоциации молекул (N 2-945, СО — 1076 кДж/моль), межъядерных расстояний в молекулах (соответственно 0,110 и 0,113 нм), температур плавления (63 и 68 К) и кипения (77 и 82 К).
Рассмотренные примеры показывают, что метод МО успешно объясняет строение и свойства таких молекул, описание которых с помощью метода ВС встречает существенные затруднения.
46. Ионная связь.
Связь такого типа осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов. Ионы могут быть простыми, т. е. состоящими из одного атома (например, катионы Na +,K +анионы F -, Cl -), или сложными, т. е. состоящими из двух или более атомов, (например, катион NH 4 +, анионы OH -, NO 3 -, SO 4 2-). Простые ионы, обладающие положительным зарядом, легче всего образуются из атомов элементов с низким потенциалом ионизации; к таким элементам относятся металлы главных подгрупп I и II группы (см. табл. 4 и 5 на стр. 97).
- 144 -
Образование простых отрицательно заряженных ионов, напротив, характерно для атомов типичных неметаллов, обладающих большим сродством к электрону. Поэтому к типичным соединениям с ионным типом связи относятся галогениды щелочных металлов, например, NaCl, CsF и т. п.
В отличие от ковалентной связи, ионная связь не обладает направленностью, Это объясняется тем, что электрическое поле иона обладает сферической симметрией, т. е. убывает с расстоянием по одному и тому же закону в любом направлении. Поэтому взаимодействие между ионами осуществляется одинаково независимо от направления. Как уже отмечалось выше (см. рис. 29 на стр. 119), система из двух зарядов, одинаковых по абсолютной величине, но противоположных по знаку, создает в окружающем пространстве электрическое поле. Это означает, что два разноименных иона, притянувшиеся друг к другу, сохраняют способность электростатически взаимодействовать с другими ионами. В этом состоит еще одно различие между ионным и ковалентным типами связи: ионная связь не обладает насыщаемостью. Поэтому к данному иону может присоединиться различное число ионов противоположного знака. Это число определяется относительными размерами взаимодействующих ионов, а также тем, что силы притяжения разноименно заряженных ионов должны преобладать над силами взаимного отталкивания, действующими между ионами одного знака.
Читать дальшеИнтервал:
Закладка:








