Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
- 138 -
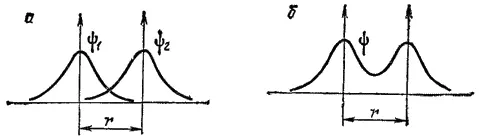
Рис. 43. Схема образования связывающей МО из атомных 1s-орбиталей.
В результате возникают силы притяжения положительно заряженных атомных ядер к этой области — образуется химическая связь. Поэтому МО рассматриваемого типа называется связывающей.
В данном случае область повышенной электронной плотности находится вблизи оси связи, так что образовавшаяся МО относится к σ-типу. В соответствии с этим, связывающая МО, полученная в результате взаимодействия двух атомных 1s-орбиталей, обозначается σ СВ1s.
Электроны, находящиеся на связывающей МО, называются связывающими электронами.
Как указывалось на стр. 76, волновая функция ψ -орбитали обладает постоянным знаком. Для отдельного атома выбор этого знака произволен: до сих пор мы считали его положительным. Но при взаимодействии двух атомов знаки волновых функций их 1s-орбиталей могут оказаться различными. Значит, кроме случая, изображенного на рис. 43, а, где знаки обеих волновых функций одинаковы, возможен и случай, когда знаки волновых функций взаимодействующих 1s-орбиталей различны. Такой случай представлен на рис. 44,а: здесь волновая функция ψ -орбитали одного атома положительна, а другого — отрицательна. Пр и сложении этих волновых функций получится кривая, показанная на рис. 44, б. Молекулярная орбиталь, образующаяся при подобном взаимодействии, характеризуется уменьшением абсолютной величины волновой функции в межъядерном пространстве по сравнению с ее значением в исходных атомах: на оси связи появляется даже точка, в которой значение волновой функции, а, следовательно, и ее квадрата, обращается в нуль. Это означает, что в рассматриваемом случае уменьшится и плотность электронного облака в пространстве между атомами.
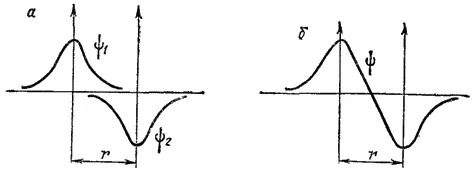
Рис. 44. Схема образования разрыхляющей МО из атомных 1s-орбиталей.
- 139 -
В результате притяжение каждого атомного ядра в направлении к межъядерной области пространства окажется более слабым, чем в противоположном направлении, т. е. возникнут силы, приводящие к взаимному отталкиванию ядер. Здесь, следовательно, химическая связь не возникает; образовавшаяся в этом случае МО называется разрыхляющей (σ разр1s) , а находящиеся на ней электроны — разрыхляющими электронами.
Переход электронов с атомных 1s-орбиталей на связывающую МО, приводящий к возникновению химической связи, сопровождается выделением энергии. Напротив, переход электронов с атомных 1s-орбиталей на разрыхляющую МО требует затраты энергии. Следовательно, энергия электронов на орбитали σ св1s ниже, а на орбитали σ разр1s выше, чем на атомных 1s-орбиталях. Это соотношение энергий показано на рис. 45, на котором представлены как исходные 1s-орбитали двух атомов водорода, так и молекулярные орбитали σ св1s и σ разр1s. Приближенно можно считать, что при переходе 1s-электрона на связывающую МО выделяется столько же энергии, сколько необходимо затратить для его перевода на разрыхляющую МО.
Мы знаем, что в наиболее устойчивом (невозбужденном) состоянии атома электроны занимают атомные орбитали, характеризующиеся наименьшей возможной энергией. Точно так же наиболее устойчивое состояние молекулы достигается в том случае, когда электроны занимают МО, отвечающие минимальной энергии. Поэтому при образовании молекулы водорода оба электрона перейдут с атомных 1s-орбиталей на связывающую молекулярную орбиталь σ св1s (рис. 46); в соответствии с принципом Паули, электроны, находящиеся на одной МО, должны обладать противоположно направленными спинами.
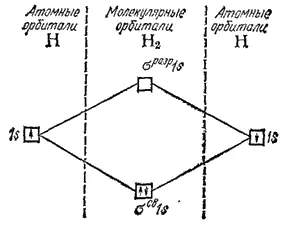
Рис. 45. Энергетическая схема образования МО при взаимодействии 1s-орбиталей двух одинаковых атомов.
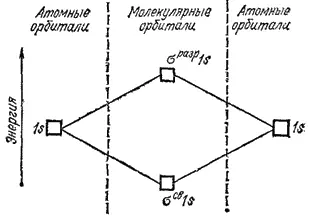
Рис. 46. Энергетическая схема образования молекулы водорода.
- 140 -
Используя символы, выражающие размещение электронов на атомных и молекулярных орбиталях, образование молекулы водорода можно представить схемой:
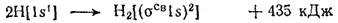
В методе ВС кратность связи определяется числом общих электронных пар: простой считается связь, образованная одной общей электронной парой, двойной — связь, образованная двумя общими электронными парами, и т. д. Аналогично этому, в методе МО кратность связи принято определять по числу связывающих электронов, участвующих в ее образовании: два связывающих электрона соответствуют простой связи, четыре связывающих электрона — двойной связи и т. д. При этом разрыхляющие электроны компенсируют действие соответствующего числа связывающих электронов. Так, если в молекуле имеются 6 связывающих и 2 разрыхляющих электрона, то избыток числа связывающих электронов над числом разрыхляющих равен четырем, что соответствует образованию двойной связи. Следовательно, с позиции метода МО химическую связь в молекуле водорода,образованную двумя связывающими электронами, следует рассматривать как простую связь.
Теперь становится понятной возможность существования устойчивого молекулярного иона H 2 +. При его образовании единственный электрон переходит с атомной орбитали 1s на связывающую орбиталь σ св1s, что сопровождается выделением энергии (рис. 47) и может быть выражено схемой:
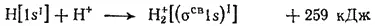
В молекулярном ионе H 2 +(рис. 48) имеется всего три электрона. На связывающей молекулярной орбитали σ св1s могут разместиться, согласно принципу Паули, только два электрона, по этому третий электрон занимает разрыхляющую орбиталь σ разр1s.
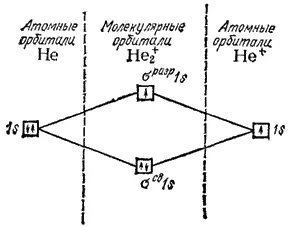
Рис. 47. Энергетическая схема образования молекулярного иона водорода H 2 +.
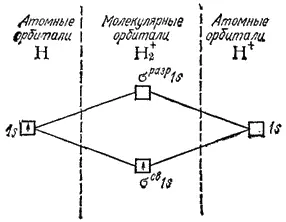
Рис. 48. Энергетическая схема образования молекулярного иона гелия He 2 +.
- 141 -
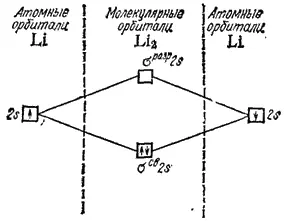
Рис. 49. Энергетическая схема образования молекулы лития Li 2.
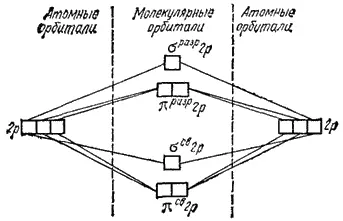
Интервал:
Закладка:








