Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Отсутствие у ионной связи направленности и насыщаемости обусловливает склонность ионных молекул к ассоциации, т. е. к соединению их друг с другом. При высоких температурах кинетическая энергия движения молекул преобладает над энергией их взаимного притяжения: поэтому в газообразном состоянии ионные соединения существуют в основном в виде неассоциированных молекул. Но при понижении температуры, при переходе в жидкое и, особенно, в твердое состояние ассоциация ионных соединений проявляется сильно. Все ионные соединения в твердом состоянии имеют не молекулярную, а ионную кристаллическую решетку (см. гл. V), в которой каждый ион окружен несколькими ионам» противоположного знака. При этом все связи данного иона с соседними ионами равноценны, так что весь кристалл можно рассматривать как единую гигантскую «молекулу».
Как указывалось в § 34, атомы неметаллов характеризуются положительными значениями сродства к электрону: при присоединении электрона к такому атому выделяется энергия. Однако присоединение второго электрона к атому любого неметалла требует затраты энергии, так что образование простых многозарядных анионов (например, O 2-, N 3-) оказывается энергетически невыгодным. Поэтому в таких соединениях, как оксиды (BaO, Al 2O 3и др.) или сульфиды (например, ZnS, CuS), не образуется «чисто» ионная связь: здесь химическая связь всегда носит частично ковалентный характер.
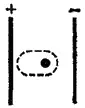
Рис. 54. Поляризация иона в электрическом поле.
- 145 -
Вместе с тем, многозарядные сложные анионы SO 4 2-, CO 3 2-, PO 4 3-и т. п.) могут быть энергетически устойчивыми, поскольку избыточные электроны распределены между несколькими атомами, так что эффективный заряд каждого из атомов не превышает заряда электрона.
Но даже в типичных ионных соединениях, например, в галогенидах щелочных металлов, не происходит полного разделения отрицательного и положительного зарядов, т. е. полного перехода электрона от одного атома к другому. Например, в кристалле NaCl эффективный отрицательный заряд атома хлора составляет лишь 0,94 заряда электрона; таким же по абсолютной величине положительным зарядом обладает и атом натрия.
Неполное разделение зарядов в ионных соединениях можно объяснить взаимной поляризацией ионов, т. е. влиянием их друг на друга, которое приводит к деформации электронных оболочек ионов. Причиной поляризации всегда служит действие электрического поля (см., например, рис. 54, пунктиром показана деформация электронной оболочки иона в электрическом поле), смещающего электроны и ядра атомов в противоположных направлениях. Каждый ион, будучи носителем электрического заряда, является источником электрического поля. Поэтому, взаимодействуя, противоположно заряженные ионы поляризуют друг друга.
Наибольшее смещение испытывают при поляризации электроны внешнего слоя; в первом приближении можно считать, что деформации подвергается только внешняя электронная оболочка. Однако под действием одного и того же электрического поля различные ионы деформируются в разной степени. Иначе говоря, поляризуемость различных ионов неодинакова: чем слабее связаны внешние электроны с ядром, тем легче поляризуется ион, тем сильнее он деформируется в электрическом поле. У ионов одинакового заряда, обладающих аналогичным строением внешнего электронного слоя, поляризуемость возрастает с увеличением размеров иона, так как внешние электроны удаляются все дальше от ядра, экранируются все большим числом электронных слоев и в результате слабее удерживаются ядром. Так, у ионов щелочных металлов поляризуемость возрастает в ряду
Li +++++
Точно так же поляризуемость ионов галогенов изменяется в следующей последовательности:
F --
--
Превращение атома в положительно заряженный ион всегда приводит к уменьшению его размеров (см. стр. 95). Кроме того, избыточный положительный заряд катиона затрудняет деформацию его внешних электронных облаков.
- 146 -
Напротив, отрицательно заряженные ионы всегда имеют большие размеры, чем нейтральные атомы, а избыточный отрицательный заряд приводит здесь к отталкиванию электронов и, следовательно, к ослаблению их связи с ядром. По этим причинам поляризуемость анионов, как правило, значительно выше поляризуемости катионов.
Поляризующая способность ионов, т. е. их способность оказывать деформирующее воздействие на другие ионы, также зависит от заряда и размера иона. Чем больше заряд иона, тем сильнее создаваемое им электрическое поле; следовательно, наибольшей поляризующей способностью обладают многозарядные ноны. При одном и том же заряде напряженность электрического поля вблизи иона тем выше, чем меньше его размеры. Поэтому поляризующая способность ионов одинакового заряда и аналогичного электронного строения падает с увеличением ионного радиуса. Так, в ряду катионов щелочных металлов поляризующая способность изменяется в порядке, обратном порядку изменения поляризуемости:
Li +>Na +>K +>Rb +>Cs +
Как упоминалось выше, размеры анионов, вообще говоря, больше размеров катионов. Вследствие этого анионы, как правило, обладают меньшей поляризующей способностью, чем катионы.
Таким образом, анионы в сравнении с катионами характеризуются сильной поляризуемостью и слабой поляризующей способностью. Поэтому при взаимодействии разноименных ионов поляризации подвергается главным образом отрицательный ион; поляризацией положительного иона в большинстве случаев можно пренебречь.
Влияние на поляризацию аниона его размеров, а также размеров и заряда катиона иллюстрируется схемой, изображенной на рис. 55.
В результате поляризующего действия катиона внешнее электронное облако аниона смещается (рис. 56). Происходит как бы обратный перенос части электронного заряда от аниона к катиону. Это и приводит к тому, что эффективные заряды атомов в ионном соединении оказываются меньше целого заряда электрона.
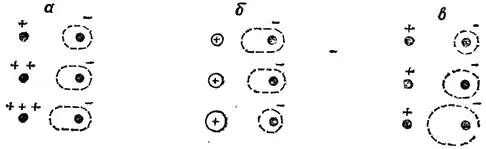
Рис. 55. Схема влияния на поляризацию отрицательных ионов: а — заряда положительного иона; б — размера положительного иона, в — размера отрицательного иона.
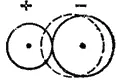
Рис. 56. Смещение электронного облака аниона в результате поляризации. Положение деформированного электронного облака показано пунктиром.
Рис. 56 показывает также, что в результате поляризации электронные облака катиона и аниона оказываются не полностью разделенными и частично перекрываются, так что связь между атомами из чисто ионной превращается в сильно полярную ковалентную связь. Из этого следует, что ионную связь можно рассматривать не как особый вид связи, а как предельный случай полярной ковалентной связи.
Читать дальшеИнтервал:
Закладка:








