Ричард Фейнман - Том 3. Квантовая механика
- Название:Том 3. Квантовая механика
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ричард Фейнман - Том 3. Квантовая механика краткое содержание
Том 3. Квантовая механика - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
В органической химии при работе с подобного рода теорией используют еще одну идею. Она, пожалуй, самая удачная из всех (или по крайней мере в определенном смысле самая точная). Она отвечает на такой вопрос: в каких случаях получается особенно прочная химическая связь? Ответ очень интересен. Возьмем вначале для примера бензол и представим ряд событий, которые произойдут, если мы начнем с шестикратно ионизованной молекулы и примемся добавлять новые и новые электроны. Тогда нужно будет говорить о различных ионах бензола — отрицательных и положительных. Изобразим энергию иона (или нейтральной молекулы) как функцию числа электронов. Если мы примем Е 0=0 (мы не знаем, чему равно E 0), то получим кривую, показанную на фиг. 13.13.
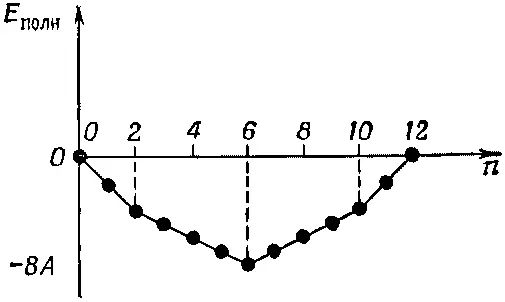
Фиг. 13.13. Сумма всех энергий электронов, когда нижние состояния на фиг. 13.8 заполнены n электронами (принято E 0 =0).
Для первых двух электронов наклон функции постоянен — это прямая линия. Затем для каждой очередной группы электронов он возрастает, меняясь скачком от одной группы к другой. Наклон изменяется тогда, когда заканчивается заполнение системы уровней с одной энергией и очередному электрону приходится переходить к очередной более высокой системе уровней.
В действительности истинная энергия иона бензола совершенно непохожа на фиг. 13.13 из-за взаимодействий электронов и из-за электростатических энергий, которыми мы пренебрегли. Эти поправки, однако, меняются с n довольно плавно. Даже если бы их все учесть, на окончательной энергетической кривой все равно остались бы изломы при таких n , при которых как раз заполняются отдельные уровни энергии.
Рассмотрим теперь очень гладкую кривую, на которой в среднем укладываются все точки (фиг. 13.14).
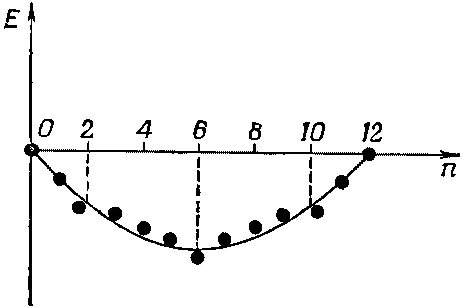
Фиг. 13.14. Точки с фиг. 13.13 и плавная кривая. Молекулы с n=2, 6, 10 устойчивее остальных.
Можно сказать, что точки над этой кривой обладают энергией «выше чем нормальной», а точки под нею «ниже чем нормальной». И в общем случае следует ожидать, что у конфигураций с «ниже чем нормальной» энергией средняя устойчивость окажется повышенной. Обратите внимание, что конфигурации, которые значительно ниже кривой, всегда оказываются в конце одного из прямолинейных отрезков, а именно там, где электронов как раз хватает на то, чтобы заполнить «энергетическую оболочку», как ее называют. Это очень точное предсказание теории. Молекулы и ионы особо устойчивы ( по сравнению с прочими подобными конфигурациями ), когда имеющиеся у них в наличии электроны как раз заполняют энергетическую оболочку .
Эта теория объяснила и предсказала некоторые весьма необычные химические факты. Вот очень простой пример. Возьмем кольцо из трех атомов. Почти невозможно поверить, что химик сможет из трех атомов составить кольцо и сделать его устойчивым. Но это было сделано. Энергетический круг для трех электронов показан на фиг. 13.15.
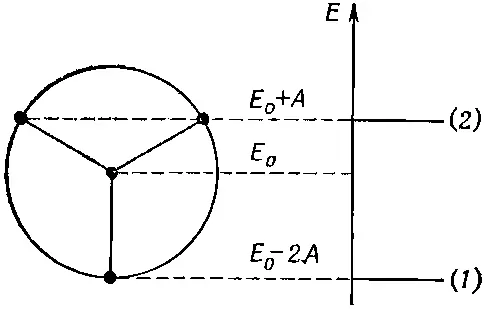
Фиг. 13.15. Энергетическая диаграмма для кольца из трех атомов.
Если поместить в нижнее состояние два электрона, то пойдут в дело только два из трех требуемых электронов. Третий электрон придется поместить на более высокий уровень. Отсюда следует, что молекула не будет слишком устойчивой. Зато двухэлектронная структура обязана быть устойчивой. И действительно, оказывается, что нейтральную молекулу трифенилциклопропанила сделать очень трудно, но зато сравнительно легко соорудить положительный ион, показанный на фиг. 13.16.
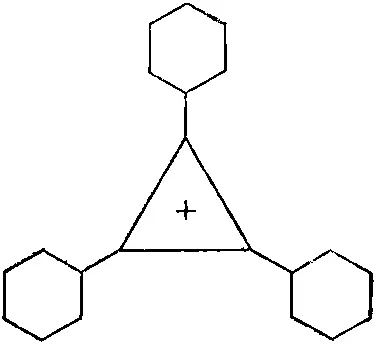
Фиг. 13.16. Катион трифенилииклопропанила.
Правда, кольцо из трех атомов никогда не бывает легко сделать, потому что, когда связи в органической молекуле образуют равносторонний треугольник, всегда появляются большие напряжения. Чтобы соединение было устойчиво, структуру нужно как-то стабилизировать. Оказывается, что, если поставить по углам три бензольных кольца, можно сделать положительный ион. (Отчего нужно добавлять бензольные кольца, непонятно.)
Подобным же образом можно также проанализировать и пятиугольное кольцо. Если вы начертите энергетическую диаграмму, то качественно сможете убедиться, что шестиэлектронная структура должна быть особо устойчива, так что такая молекула должна быть устойчивее всего в виде отрицательного иона. И вот кольцо из пяти атомов действительно хорошо известно, легко сооружается и действует всегда как отрицательный ион. Подобным же образом вы легко убедитесь, что кольцо из 4 и 8 атомов не очень интересно, а кольцо из 14 или 10 (как и кольцо из 6) должно быть особенно устойчиво в форме нейтрального объекта.
§ 6. Другие применения приближения
Есть два других сходных случая, на которых мы остановимся лишь вкратце. Говоря о строении атома, можно считать, что электрон заполняет последовательные оболочки. Теорию движения электрона Шредингера удается с легкостью разработать лишь для отдельного электрона, движущегося в «центральном» поле — поле, зависящем только от расстояния от точки. Но как же тогда разобраться в том, что происходит в атоме, в котором 22 электрона?! Один из путей — воспользоваться приближением независимых частиц. Сперва вы подсчитываете, что происходит с одним электроном. Получаете сколько-то там уровней энергии. Помещаете электрон в нижнее энергетическое состояние. В грубой модели вы продолжаете игнорировать взаимодействия электронов и продолжаете заполнять последовательные оболочки, но еще лучшие ответы получатся, если учесть (хотя бы приближенно) влияние электрического заряда электрона. Добавляя электрон, каждый раз вычисляйте амплитуду того, что он будет обнаружен в различных местах, и затем с ее помощью прикидывайте вид сферически симметричного распределения заряда. Поле этого распределения (совместно с полем положительного ядра и всех предыдущих электронов) используйте для расчета состояний, доступных очередному электрону. Таким путем вы можете получить вполне разумные оценки энергий нейтрального атома и различных ионизованных состояний. Вы увидите, что и здесь имеются энергетические оболочки, так же как у электронов в кольцевой молекуле. При не совсем заполненной оболочке атом иногда охотнее присоединяет к себе один или несколько электронов, а иногда охотнее их теряет, чтобы прийти в устойчивое состояние, когда оболочка заполнена.
Читать дальшеИнтервал:
Закладка:






