А. Березовчук - Физическая химия: конспект лекций
- Название:Физическая химия: конспект лекций
- Автор:
- Жанр:
- Издательство:Конспекты, шпаргалки, учебники «ЭКСМО»b4455b31-6e46-102c-b0cc-edc40df1930e
- Год:2009
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
А. Березовчук - Физическая химия: конспект лекций краткое содержание
Данное учебное пособие предназначено для студентов химических факультетов высших учебных заведений педагогического и технического направления. Изложены основные концепции и процессы, составляющие современную физическую химию. Материал соответствует государственному стандарту. Пособие рекомендовано в помощь студентам при подготовке к экзаменам.
Физическая химия: конспект лекций - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
2. Пусть металл является слабым восстановителем, тогда его ионы, содержащиеся в растворе соли, являются сильными окислителями. Некоторая часть ионов подходит к металлической поверхности и восстанавливается за счет свободных электронов, присутствующих в ней по реакции:
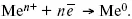
В результате процесса восстановления металлическая пластинка заряжается положительно и притягивает отрицательно заряженные частицы. При погружении малоактивных благородных металлов (Cu, Ag, Au и др.) в раствор соли наблюдается обратная картина, от первой: при любой достижимой концентрации, концентрация поверхностного раствора меньше концентрации соли металла, поэтому ионы металлов осаждаются на электроде, а в приэлектродном пространстве накапливается избыточный отрицательный заряд за счет анионов соли или ионов гидроксидной группы OH –. После достижения равновесной разницы потенциалов между металлом и раствором переход ионов в раствор прекращается.
Модельные представления о строении ДЭС на границе раздела фаз:
1) модель Гельмгольца;
2) модель Гуи, Чапмена;
3) модель Штерна;
4) модель Грэма;
5) модель современная.
Первая модель ДЭС открыта Гельмгольцем , он представлял ДЭС в виде двух обкладок плоского конденсатора, одна обкладка расположена непосредственно на поверхности электрода, вторая – в электролите.
d = диаметру молекул Н 2О.
Так как все заряды сконцентрированы в двух плоскостях, то изменение потенциала по мере удаления от поверхности электрода Е 0будет описываться прямой линией.
Е а – величина электродного удаления от поверхности электрода потенциала.
Используя теорию конденсатора, Гельмгольц рассчитал величину заряда ДЭС и величину дифференциальной емкости ДЭС.
q – величина заряда = ( D /4 π 2) Е 0, С – дифференциальная емкость ДЭС = D /4 π 2, D – диэлектрическая проницаемость раствора, d – расстояние между обкладками конденсатора.
Теория Гельмгольцапозволила объяснить ход электрокапиллярной кривой, рассчитать величину дифференциальной емкости ДЭС, хорошо совпадающую с экспериментально полученными данными. Наилучшая сходимость была получена для концентрированных растворов элементов, однако данная теория не объясняла зависимость плотности заряда и дифференциальной емкости ДЭС от состава электролита и концентрации компонента.
Недостатки теории Гельмгольца:
1) не учитывалось тепловое движение ионов в растворе;
2) не учитывался размер ионов;
3) не рассматривались процессы адсорбции на границе раздела фаз (электрод – электролит).
Ее применяют только к концентрированным растворам, не содержащим поверхностно-активные вещества (ПАВ).
Б. Гуи , Д. Чапмен учли тепловое движение в растворах электролитов.
Эта теория позволяет рассчитать плотность ρ заряда ДЭС и величину дифференциальной емкости С , они учли влияние концентрации, но рассчитанные значения дифференциальной емкости С, но они меньше сходятся с экспериментально полученными результатами. Теория Гуи, Чапменаприменима к разбавленным растворам электролитов.
Недостатки:
1) не учитываются размеры ионов;
2) не учитывается явление адсорбции на границе раздела фаз.
В. Штерн учел, что в электролитах наблюдается электростатическое взаимодействие между ионами, тепловое движение компонентов электролита и возможное специфическое взаимодействие компонентов электролита с поверхностью электрода.
Он соединил теорию Гельмгольца с теорией Гуи, Чапмен, в результате ДЭС представлялся состоящим из двух частей:
1) плотной части Гельмгольца;
2) диффузной части по модели Гуи, Чапмена.
За счет адсорбции ПА компонента может происходить перезаряд поверхности. Штерн считал, что адсорбция происходит на границе плотной и диффузной части ДЭС. Эта граница называется плоскостью Гельмгольца.
Теория Штерналегла в основу современных представлений и развивалась в работах Грема , Фрумкина , Эршлера , Есина и др.
Недостатки:
1) не учитывал дискретность зарядов;
2) величина емкости, рассчитанная по модельным представлениям Штерна, не соответствовала экспериментально полученным результатам.
Г. Греем рассмотрел возможность адсорбции ПА анионов внутри плотной части ДЭС, он ввел понятие внутренней и внешней плоскости Гельмгольца.
Адсорбция анионов происходит на внутренней плоскости Гельмгольца.
Недостаток:рассматривал адсорбцию только анионов и не учитывал дискретность зарядов.
О. А. Есин рассмотрел дискретность зарядов и показал, что ионы, образующие внутреннюю и внешнюю плоскости Гельмгольца, взаимодействуют между собой, образуя диполи.
Указанное взаимодействие влияет на величину диффузной емкости с ДЭС. О. А. Есин рассмотрел возможность адсорбции на внутренней плоскости Гельмгольца как катионов, так и анионов.
8. Проводники первого и второго рода
Проводники– вещества, проводящие электрический ток благодаря наличию в них большого количества зарядов, способных свободно перемещаться (в отличие от изоляторов). Они бывают I (первого) и II (второго) рода. Электропроводность проводников I рода не сопровождается химическими процессами, она обусловлена электронами. К проводникам I рода относятся: чистые металлы, т. е. металлы без примесей, сплавы, некоторые соли, оксиды и ряд органических веществ. На электродах, выполненных из проводников I рода, происходит процесс переноса катиона металла в раствор или из раствора на поверхность металла. К проводникам II рода относятся электролиты. В них прохождение тока связано с химическими процессами и обусловлено движением положительных и отрицательных ионов.
Электроды первого рода.В случае металлических электродов первого рода такими ионами будут катионы металла, а в случае металлоидных электродов первого рода – анионы металлоида. Серебряный электрод первого рода Ag +/Ag. Ему отвечает реакция Ag ++ e - = Ag и электродный потенциал
E Ag +/Ag = Ag +/ Ag+ b 0lg a Ag +.
После подстановки численных значений Е 0и b 0при 25 oС:
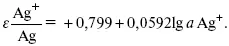
Примером металлоидных электродов первого рода может служить селеновый электрод Se 2–/Se, Se + 2 e - = Se 2; при 25 oС E Se 2–/Se 0= –0,92 – 0,03lg a Se 2–.
Читать дальшеИнтервал:
Закладка:










