А. Березовчук - Физическая химия: конспект лекций
- Название:Физическая химия: конспект лекций
- Автор:
- Жанр:
- Издательство:Конспекты, шпаргалки, учебники «ЭКСМО»b4455b31-6e46-102c-b0cc-edc40df1930e
- Год:2009
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
А. Березовчук - Физическая химия: конспект лекций краткое содержание
Данное учебное пособие предназначено для студентов химических факультетов высших учебных заведений педагогического и технического направления. Изложены основные концепции и процессы, составляющие современную физическую химию. Материал соответствует государственному стандарту. Пособие рекомендовано в помощь студентам при подготовке к экзаменам.
Физическая химия: конспект лекций - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Пример: 1 моль H 2SO 4– 98 г, до одного литра надо добавить воду.
Моляльность– число молей растворенного вещества на 1000 г растворителя. Пример:
H 2SO 4– 98 г/моль+1000 г H 2O.
Мольная доля растворенного вещества в растворе, N
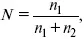
где n 1– растворенное вещество (моль);
n 2– растворитель (моль).
Пример: имеем 20% NaOH (едкий натр).

Титр– число растворенного вещества в одном миллилитре раствора. Существует титриметрический анализ – метод количественного анализа, при котором содержание определяемого вещества Х рассчитывают на основании измерения количества реактива, затраченного на взаимодействие с Х , выполнение реакции в титриметрическом анализе является конечной стадией анализа. Пример: объем кислоты оттитруем щелочью каплями до исчезновения окрас-ки – полная нейтрализация. При титровании
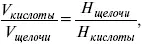
где Н – нормальность – число моль-эквивалентов растворенного вещества в одном литре раствора.
Основной характеристикой растворов является их растворимость– масса вещества, способная раствориться в ста граммах растворителя при данной температуре; этот процесс сопровождается тепловым эффектом. Количественно растворимость твердого тела, газа, жидкости в жидком растворителе определяется концентрацией насыщенного раствора при данной температуре, т. е. сколько вещества по массе (объему) в данном растворителе. Пример: m (NaCl) – 58,5 г на 100 г H 2O при данной температуре. Насыщенный раствор– раствор, находящийся в равновесии, с избытком растворяемого вещества. Пересыщенный– неустойчивый раствор, содержащий больше вещества, чем это определяется его растворимостью.
Качественная характеристика состоит в способности растворяться или не растворяться, например, сера в воде не растворяется, йод в воде практически нерастворим. Процесс растворения состоит из двух стадий:
1. Растворимость в воде твердых веществ (разрушение кристаллов – эндотермическая реакция, т. е. тепло поглощается – q 1).
2. Отдельные частицы взаимодействуют с водой, этот процесс носит название – гидратация, при ней тепло выделяется + q 2
Q раствореия= – q 1+ q 2.
Если – q 1> q 2, то суммарный эффект отрицателен (– Q ), если наоборот, то положителен (+ Q ).
Δ H = 0 – одинаковые эффекты, Δ H < 0 – тепло выделяется, Δ H > 0 – тепло поглощается.
Тепловой эффект растворения– количество тепла одного моля вещества.
вещество + растворитель ↔ насыщенный раствор + Q.
То вещество, которое растворяется с понижением температуры, увеличивает свою растворимость. Рассмотрим растворимость некоторых веществ. Пример, NH 4NO 3– нитрат аммония, растворимость падает до нуля, эндотермический эффект реакции. Рассмотрим стадии подробно: на первой стадии – эффект разрушения кристаллической решетки, эндотермический. На второй – равномерное распределение по объему с водой, гидратация – экзотермический.
q 1> q 2→ – Q – тепло поглощается,
Δ H > 0.
Другой пример, NaOH – едкий натр, экзотермический эффект реакции,
q 1< q 2→ + Q – тепло выделяется.
Значит, растворимость определяется природой соли вещества и растворителя.
Другой характеристикой растворов является диэлектрическая проницаемость– во сколько раз сила взаимодействия между двумя зарядами меньше, чем в вакууме.
Если растворить в ста миллилитрах водопроводной воды 10 г едкого натра NaOH, то температура резко повышается до 60 oС (температура воды из водопроводного крана +20 oС).
Если растворить 40 г нитрата аммония NH 4NO 3в 100 мл этой же воды, то температура резко понижается от +20 oС до –7 oС.
Если растворить хлорид натрия NaCl в 100 мл водопроводной воды, то температура не изменяется.
3. Растворимость газов в жидкостях
Она зависит от давления и температуры. Растворимость газов неодинакова из-за различной химической природы.
Пример:
N 2, H 2– мало растворимы в воде, растворимость NH 3, HCl очень велика, в одном объеме H 2O растворяется 700 объемов аммиака NH 3.
Газ + H 2O → 3,5 объема О 2в одном объеме Н 2О экзотермический процесс. С повышением температуры растворимость некоторых газов уменьшается. При постоянной температуре и невысоком давлении растворимость газов, не вступающих в химическое взаимодействие с растворителем, подчиняется закону Генри – Дальтона, который состоит из нескольких частей.
1 часть:масса газа, растворяющаяся в данном объеме жидкости, пропорциональна давлению, которое газ производит на жидкость.
Например, CO 2под давлением загоняем в бутылку.
2 часть:объем газа не зависит от давления.
3 часть:если смесь газов растворять, то растворимость каждой составной части пропорциональна своему парциальному давлению.
Газы, реагирующие с водой, не подчиняются закону Генри – Дальтона.
4. Растворы неэлектролитов. Закон Рауля и его следствия
Рассмотрим модель идеального раствора. Раствор называется идеальным, если в нем отсутствует взаимодействие между частицами (молекулами, атомами, ионами). Растворы неэлектролитов– частицы, плохо растворимые в воде, так как нет носителя электрического заряда. Закон Рауля справедлив только для разбавленных растворов неэлектролитов.
Пусть P BO – давление пара над чистым растворителем, при постоянной температуре T 1; P B – давление пара растворителя при этой же температуре, но над раствором, состоящим из нелетучего компонента А (сахар), и чистым жидким растворителем В :
P B = f ( T ).
Разность P BO – P B равна понижению давления пара.
Величина (P BO– P B) /P BO – относительное понижение упругости пара = X A= Δ P/P BO , где X A – мольная доля, P BO> P B, Δ P = P BO– P B – абсолютное понижение упругости пара.
Закон Рауля.Относительное понижение упругости пара растворителя над раствором равно мольной доле растворенного нелетучего компонента.
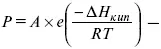
барометрическая формула Больцмана.
Следствия из закона Рауля:
1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы.
Читать дальшеИнтервал:
Закладка:










