Ричард Фейнман - 9. Квантовая механика II
- Название:9. Квантовая механика II
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ричард Фейнман - 9. Квантовая механика II краткое содержание
9. Квантовая механика II - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Но так как самая внешняя оболочка марганца, железа, кобальта и никеля имеет одну и ту же конфигурацию, то все они обладают близкими химическими свойствами. (Этот эффект еще сильнее выражен у редкоземельных элементов. У них внешняя оболочка одинакова, а заполняется постепенно внутренняя ячейка, что меньше сказывается на их химических свойствах.) То же и в меди. В ней тоже построение З d -оболочки завершается грабежом: из 4 s -оболочки уводится один электрон. Энергия комбинации 10, 1, однако, настолько близка у меди к энергии комбинации 9, 2, что равновесие может сместиться уже оттого, что поблизости стоит другой атом. По этой причине два последних электрона меди примерно равноценны, и валентность меди равна то 1, то 2. (Временами она проявляет себя так, как если бы ее электроны были в комбинации 9, 2.) Похожие вещи случаются и в других местах таблицы; они-то и ответственны за то, что другие металлы, такие, как железо, соединяются химически то с той, то с другой валентностью. Наконец, у цинка обе оболочки 3d и 4s заполняются раз и навсегда.
От Ga до Kr
От галлия до криптона последовательность опять продолжается нормально, заполняя 4 p -оболочку. Внешние оболочки, энергии и химические свойства повторяют картину изменений на участке от бора до неона и от алюминия до аргона.
Криптон, как и аргон или неон, известен как «благородный» газ. Все эти три «благородных» газа химически «инертны». Это означает только то, что после того, как они заполнили оболочки со сравнительно низкими энергиями, редки будут случаи, когда им станет энергетически выгодно соединиться в простые сочетания с другими элементами. Но для «благородства» недостаточно просто обладать заполненной оболочкой. У бериллия, например, или у магния заполнены s-оболочки, но энергия этих оболочек чересчур высока, чтобы можно было говорить об устойчивости. Точно так же можно было бы ожидать появления другого «благородного» элемента где-то возле никеля, если бы энергия у 3 d -оболочки была бы чуть пониже (или у 4 s -оболочки повыше). С другой стороны, криптон не вполне инертен; он образует с хлором слабо связанное соединение.
Поскольку в рассмотренной нами части таблицы уже проявились все основные черты периодической системы, мы обрываем наше изложение на элементе № 36 (их остается еще штук 70, а то и больше!).
Мы хотим отметить еще один момент: мы в состоянии понять в какой-то степени не только валентности, но можем кое-что сказать и о направлениях химических связей. Возьмем такой атом, как кислород. В нем четыре 2 р -электрона. Первые три попадают в состояния « x », « у » и « z », а четвертый вынужден заполнить одно из них, оставив два других — скажем, « x » и « у » — вакантными. Посмотрите теперь, что происходит в Н 2O. Каждый из двух водородов желает разделить свой электрон с кислородом, помогая кислороду заполнить оболочку. Эти электроны будут стремиться попасть на вакансии в состояниях « x » и « y ». Поэтому два водорода в молекуле воды обязаны расположиться под прямым углом друг к другу, если смотреть из центра атома кислорода. На самом деле угол равен 105°. Можно даже понять, почему угол больше 90°. Обобществив свои электроны с кислородом, водороды остаются в конце концов с избытком положительного заряда. Электрическое отталкивание «растягивает» волновые функции и разводит угол до 105°. Так же обстоит дело и у H 2S. Но атом серы крупнее, атомы водорода оказываются дальше друг от друга, и угол расходится только до 93°. А селен еще крупнее, поэтому в H 2Se угол уже совсем близок к 90°.
Аналогичные рассуждения позволяют разобраться в геометрии аммиака H 3N. В азоте есть место еще для трех 2 р -электронов, по одному на каждое состояние типа « x », «у» и « z ». Три водорода будут вынуждены подсоединиться под прямыми углами друг к другу. Углы снова окажутся чуть больше 90°, опять-таки из-за электрического отталкивания, но по крайней мере теперь ясно, отчего молекула H 3N не плоская. Углы в фосфине Н 3Р уже ближе к 90°, а в H 3As еще ближе. Мы не зря предположили, что NH 3не плоский, когда говорили о нем как о системе с двумя состояниями. Именно из-за этой объемности аммиака и возможен аммиачный мазер. Вы видите, что сама форма молекулы аммиака тоже следует из квантовой механики. Уравнение Шредингера явилось одним из величайших триумфов физики. Снабдив нас ключом к механизму, лежащему в основе строения атома, оно объяснило атомные спектры и всю химию, благодаря чему стала понятна физическая природа материи.
* В действительности мнение об инертности благородных газов оказалось, как и многое другое, сильным преувеличением. Криптон, например, весьма охотно соединяется с фтором, образуя кристаллы KrF 6 . Сейчас химия инертных газов превращается в большую и увлекательную науку.— Прим. ред.
* Это нетрудно вывести из (16.35). Но можно это сделать, исходя из основных принципов; надо только воспользоваться идеями, изложенными в гл. 16, § 4. Состояние |l, l> может быть составлено из 2l частиц со спином 1 / 2 , у которых спин направлен вверх; а в состоянии |l, 0> l спинов было бы направлено вверх, а l — вниз. При повороте амплитуда того, что спин останется тем же, равна cosq/2, а амплитуда того, что он перевернется, равна sin q/2. А нас интересует амплитуда того, что l спинов не перевернутся, а другие l перевернутся. Такая амплитуда равна (cosq/2sinq/2) l , а это то же самое, что sin l q.
* Поскольку это и другие особые наименования являются частью общепринятого словаря атомной физики, вам попросту придется выучить их. Мы вам поможем их запомнить, поместив в этой главе небольшой «словарик» подобных терминов.
* Как обычно, 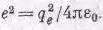
Глава 18
ОПЕРАТОРЫ
§ 1. Операции и операторы
§ 2. Средние энергии
§ 3. Средняя энергия атома
§ 4. Оператор места
§ 5. Оператор импульса
§ 6. Момент количества движения
§ 7. Изменение средних со временем
§ 1. Операции и операторы
Для того чтобы управиться со всем, что мы до сих пор делали в квантовой механике, достаточно было бы обычной алгебры, но мы все же время от времени демонстрировали особые способы записи квантовомеханических величин и уравнений. Мы хотели бы рассказать теперь немного больше о некоторых интересных и полезных способах описания квантовомеханических величин.
Читать дальшеИнтервал:
Закладка:






![Пол Халперн - Квантовый лабиринт. Как Ричард Фейнман и Джон Уилер изменили время и реальность [litres]](/books/1082376/pol-halpern-kvantovyj-labirint-kak-richard-fejnman.webp)

