Александр Артеменко - Удивительный мир органической химии
- Название:Удивительный мир органической химии
- Автор:
- Жанр:
- Издательство:Дрофа
- Год:2005
- Город:Москва
- ISBN:5-7107-9540-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Артеменко - Удивительный мир органической химии краткое содержание
Книга адресована старшеклассникам, учителям, а также тем, кто интересуется органической химией.
Удивительный мир органической химии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Вот такая история бензола. Что же мы сейчас знаем о строении молекулы этого соединения?
Физические и физико-химические методы исследования многое рассказали нам. Так, мы знаем, что молекула бензола имеет вид плоского правильного шестиугольника, а все шесть углеродных атомов и шесть водородных атомов лежат в одной плоскости, т. е. в плоскости этого шестиугольника. Оказалось, что связи между углеродными атомами равны между собой и длина их составляет 0,140 нм. Обратите внимание на эту величину. Она является средней между длинами одинарной (0,154 нм) и двойной (0,134 нм) связей. Это означает, что в молекуле бензола нет простого чередования простых и двойных связей, а существует особая — «полуторная» связь. Она является промежуточной между простой и двойной связями. Другими словами, в молекуле бензола наблюдается выравнивание одинарных и двойных связей. Вот почему все углеродные атомы в молекуле бензола равноценны и расположены друг от друга на одинаковом расстоянии. Возможно ли все это объяснить с точки зрения теории гибридизации? Давайте попробуем.
Согласно теории гибридизации все углеродные атомы в молекуле бензола находятся в sp 2-состоянии. Как известно, при этом углеродный атом образуют три одинаковые sp 2-гибридные орбитали. Четвертая же 2 p -орбиталь остается негибридизованной, т. е. обычной. Две из трех гибридных орбиталей одного углеродного атома, перекрываясь с такими же орбиталями двух соседних атомов углерода (справа и слева), образуют две о-связи между углеродными атомами. Третья sp 2-орбиталь, перекрываясь с 1 s -орбиталью атома водорода, образует связь С—Н (рис. 21). Всего в молекуле бензола, как вы видите, 12 σ-связей. Что же происходит с четвертой, негибридизованной 2 p -орбиталью?
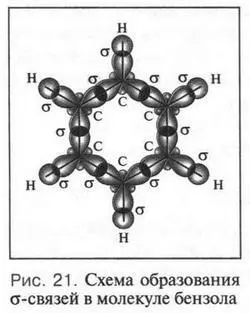
Вот она-то и играет основную роль в проявлении загадочных свойств бензольной молекулы. Эта орбиталь расположена перпендикулярно плоскости бензольного кольца. Всего таких орбиталей шесть — по одной от каждого углеродного атома. Перекрываясь «боками» друг с другом, эти орбитали создают единую π-электронную систему, общую для всех углеродных атомов бензольного кольца (рис. 22).
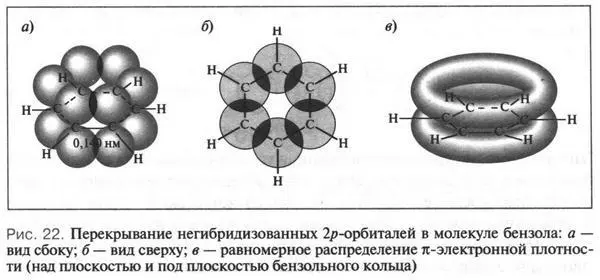
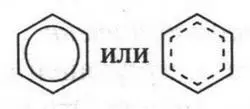
Такая система очень похожа на два «бублика», расположенных сверху и снизу кольца. Если такие «бублики» представить в виде вполне съедобных бубликов, то, положив между ними шестиугольник из сыра, получим аппетитный бутерброд, который и будет моделью молекулы бензола. Вот так образуется та особая химическая связь между углеродными атомами в молекуле бензола, которую называют ароматической связью. Все это означает, что молекула бензола — вовсе не циклогексатриен (соединение с тремя строго фиксированными двойными связями), как изображает ее формула А. Кекуле, а система с равномерным распределением π-электронного облака, т. е. со свободным перемещением π-электронов по всему шестичленному кольцу. Чтобы приблизиться к более точному изображению структурной формулы молекулы бензола, мы в шестиугольник впишем окружность или пунктирную линию, которые будут нам показывать равномерное распределение π-электронной плотности.
Объемную модель молекулы бензола можно увидеть на рисунке 23.

π-электроны, взаимодействуя друг с другом, придают молекуле бензола особые свойства, которые отличают ее от молекул углеводородов с изолированными двойными связями. Эти свойства бензола и его производных называют ароматичностью.
Особенностью ароматических соединений является легкость замещения водородных атомов кольца на другие атомы или группы атомов. Однако эта «легкость» проявляется прежде всего в том случае, когда бензол взаимодействует с положительно заряженными частицами (катионами). Приведем наиболее известные реакции такого замещения.
Реакции галогенирования (взаимодействие с галогенами). Например, реакция хлорирования начинается с образования хлор-катиона под влиянием катализатора (хлорида железа):
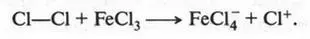
Положительно заряженная частица (хлор-катион) атакует молекулу бензола:
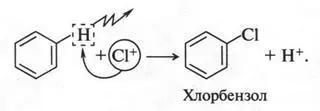
Это, конечно, не уравнение реакции, а только упрощенная схема. В действительности реакция протекает через образование неустойчивых промежуточных соединений. Но в связи со сложностью их строения мы не будем о них говорить. Скажем только, что между атомом углерода бензольного кольца и атомом хлора химическая связь устанавливается за счет пары электронов, которая осталась у углеродного атома после отщепления от него водородного атома в виде протона. Этот протон, взаимодействуя с FeCl - 4, снова образует FeCl 3(катализатор):
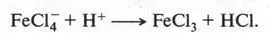
Так образуется хлорбензол.
Реакция нитрования (взаимодействие с азотной кислотой). В этой реакции на бензол действуют «нитрующей смесью» — смесью концентрированных азотной и серной кислот. Эти кислоты образуют не простую смесь, а, взаимодействуя между собой, дают несколько ионов:
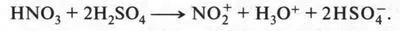
Один из этих катионов — ион нитрония NO + 2— атакует молекулу бензола (приводим опять условную схему):
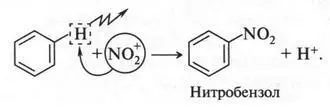
Уходящий протон связывается с анионом HSO - 4:
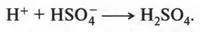
В результате образуется снова серная кислота, которая в этой реакции является катализатором. Вот так получается нитробензол.
Если нитрование проводить при нагревании (100-110 °С), то образуется 1,3,5-тринитробензол — соединение с тремя нитрогруппами в бензольном кольце.
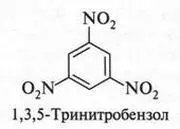
Правда, этот продукт получается с очень низким выходом (иначе его получается мало). Поскольку, как было обнаружено, такой продукт — идеальное бризантное взрывчатое вещество, то во время Второй мировой войны многие химики стали искать более подходящие условия его получения. Однако эти попытки не увенчались успехом. Но тут опять неожиданно открыли, что при нитровании толуола продукта получается больше и он также, как и 1,3,5-тринитробензол, обладает взрывчатым свойством. Этот продукт (2,4,6-тринитротолуол) назвали тротилом, или толом.
Читать дальшеИнтервал:
Закладка:









