Владимир Скулачёв - Жизнь без старости
- Название:Жизнь без старости
- Автор:
- Жанр:
- Издательство:МГУ им. М.В.Ломоносова
- Год:2014
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Владимир Скулачёв - Жизнь без старости краткое содержание
Не исключено, что это только начало пути, и уже в ближайшие годы будет создан препарат, предохраняющий от старости. Чтобы дожить до этого будущего, авторы предлагают 7 принципов, выведенных на основе биологического проникновения в глубинную природу человека. Каждый из принципов понятен и достаточно легко выполним, если вами движет любовь к жизни и своим близким. Следуя этим принципам, можно замедлить генетическую программу старения и заставить свой организм думать, что ему рано стареть.
Прочитайте, приблизьтесь к фонтану молодости — и живите долго!
Жизнь без старости - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
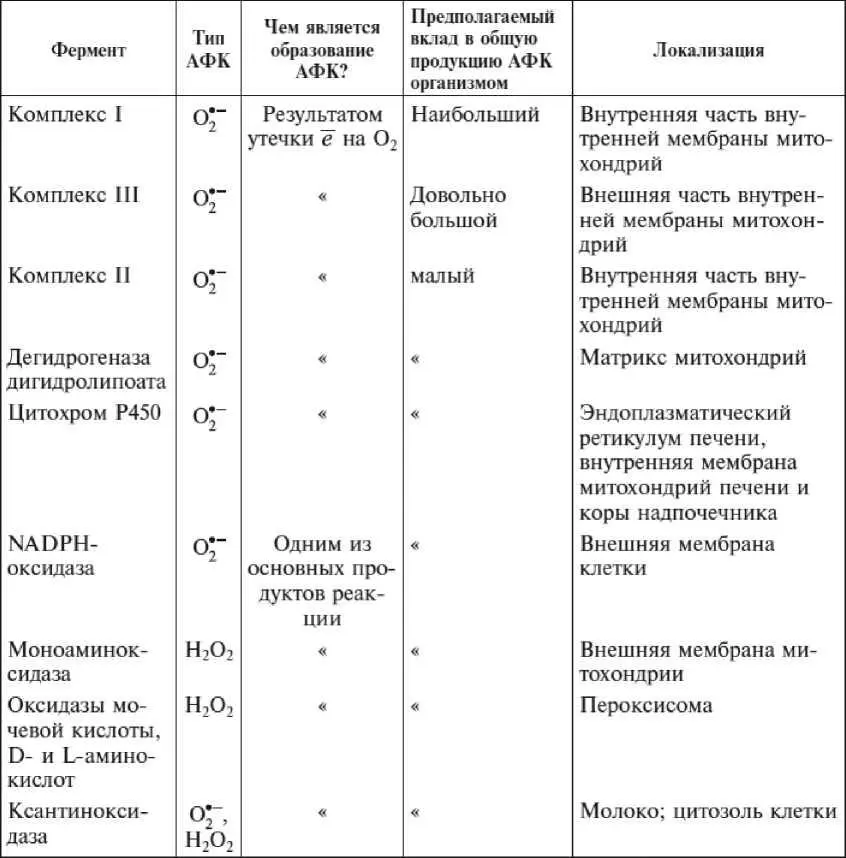
Таблица II-4.1.Генераторы АФК в живой клетке
Большему вкладу дыхательной цепи в общую генерацию АФК организмом соответствует и значительное количественное преобладание ферментов этой цепи над другими оксидазами и оксигеназами. Ферменты дыхательной цепи — один из основных компонентов внутренней мембраны митохондрий, общая площадь которой в организме человека равна примерно 14 тыс. м 2. Прямые измерения распределения АФК в разных участках живой клетки показали, что, например, вспышка образования АФК при самоубийстве дрожжевой клетки первоначально происходит в ее митохондриях.
Традиционно в качестве защиты от АФК рассматривают прежде всего вещества-антиоксиданты, убирающие ядовитые формы кислорода. Результат взаимодействия АФК и антиоксидантов состоит в том, что АФК инактивируются, а антиоксиданты, как правило, выходят из строя, теряя свои защитные свойства. Антиоксидант гибнет, как бы прикрывая собой другие, более важные биомолекулы, такие, как ДНК, РНК, белки, фосфолипиды и т. п. Иногда возможна регенерация окисленного антиоксиданта в исходную активную форму. Антиоксиданты принято делить на водорастворимые, действующие в гидрофильных областях клетки (аскорбиновая кислота, SH-глутатион, цистеин и др.), и жирорастворимые, призванные защищать мембранные структуры (CoQ, пластохинон, витамины A, D, E и K). Например, CoQH 2может восстанавливать свободнорадикальные формы липидов, окисляясь в CoQ· -. Полученный CoQ· -регенерирует в исходный CoQH 2, восстанавливаясь дыхательной цепью.
В последнее время все больше внимания уделяется биологическим механизмам защиты от АФК, снижающим продукцию активных форм кислорода в клетке, а не убирающим уже образовавшиеся АФК. Все аэробные организмы располагают глубокоэшелонированной системой защиты от АФК путем предотвращения самой их генерации. Простейшим приемом служит снижение внутриклеточной концентрации кислорода. Дело в том, что цитохромоксидаза и другие терминальные оксидазы, восстанавливающие О 2до Н 2О, сохраняют максимальную активность вплоть до концентрации кислорода, составляющей всего несколько процентов от той, которая имеется в воде при нормальном атмосферном давлении. В то же время, скорость восстановления О 2до O 2' -в митохондриях линейно зависит от концентрации O 2. Вот почему снижение в 10–20 раз уровня O 2внутри клетки ведет к резкому торможению продукции O 2 -без существенного торможения цитохромоксидазной реакции, а значит, и без уменьшения скорости дыхания и сопряженного с ним синтеза АТФ. И действительно, измерения концентрации O 2в тканях животных показали, что эта величина примерно на порядок ниже, чем в воде, насыщенной воздухом, т. е. лежит в области В на рис. II-4.2.
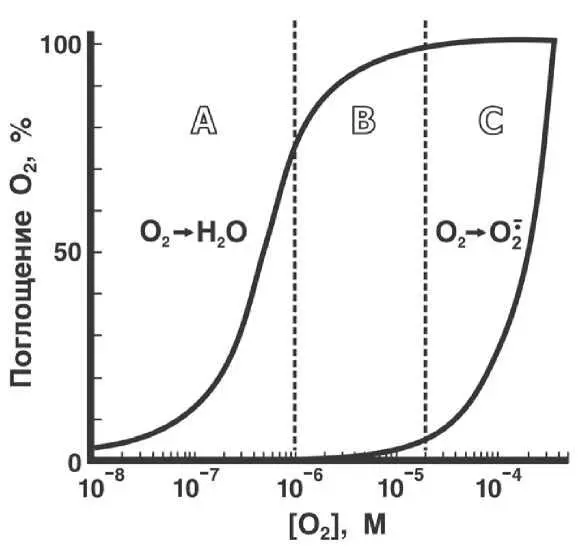
Рис. П-4.2.Ферментативное (четырехэлектронное) и неферментативное (одноэлектронное) восстановление О 2как функция от концентрации кислорода [02]. Концентрация О 2, обеспечивающая полумаксимальную скорость ферментативного восстановления (О 2 → Н 2О), считается равной 3 χ10 -7М. Принято также, что скорость неферментативного восстановления (О 2 → О 2· -) линейно повышается с ростом концентрации О 2. Скорость поглощения О 2при уровне О 2, соответствующем атмосферному давлению кислорода (0,22 мМ), взята за 100 %. При этом следует помнить, что абсолютная скорость поглощения О 2, принятая за 100 % для реакции О 2^ Н 2О, обычно по крайней мере на два порядка больше, чем для реакции О 2 → О 2· -
Эта область выгодно отличается как от области А (где [О 2] слишком мала для поддержания высокой скорости цитохромоксидазной реакции), так и от области С (где повышение [О 2] приводит к развязыванию одноэлектронного восстановления кислорода без какого-либо выигрыша для цитохромоксидазы). В любой ткани, кроме легких, [О 2] поддерживается на уровне существенно более низком, чем в равновесии с воздухом. Это происходит потому, что в покое скорость доставки О 2от легких к другим органам специально удерживается в области значений, весьма далеких от максимально возможных. Скорость доставки О 2резко возрастает при переходе от покоя к интенсивной работе. Улучшается вентиляция легких, усиливается работа сердца, растет скорость кровотока, расширяются кровеносные сосуды. Параллельно повышается потребление кислорода цитохромоксидазой из-за появления свободного АДФ. Но и в новых условиях соотношения скоростей потребления кислорода в тканях и его доставки оказываются отрегулированными таким образом, что [О 2] в клетках не увеличивается выше 10 % от насыщения на воздухе. При этом организм отслеживает концентрацию АФК в крови с помощью особых сенсоров, которые вызывают сужение сосудов в ответ на рост [О 2 -].
Стратегия, описанная выше, невозможна для одноклеточных. Так, даже азотобактер, имеющий рекордную среди живых существ скорость дыхания, не в состоянии, как показал расчет, существенно понизить внутриклеточную [О 2] из-за слишком короткой дистанции между цитозолем бактериальной клетки и внешней средой: поглощение О 2цитохромоксидазой тотчас компенсируется потоком О 2извне. Здесь на помощь приходит полисахаридная «шуба», окружающая клетку азотобактера. «Шуба» исключает конвекцию жидкости, омывающей непосредственно бактериальную стенку, что резко замедляет движение О 2из среды к бактерии. Проблема защиты от кислорода стоит для азотобактера особенно остро в средах, не содержащих солей аммония. В этом случае азотобактеру, чтобы выжить, приходится восстанавливать молекулярный азот до аммиака, чем занимается специальный фермент — нитрогеназа. Последняя чрезвычайно чувствительна к О 2, даже следы которого ее быстро инактивируют. Неудивительно, что именно в условиях фиксации N2 азотобактер включает особую упрощенную дыхательную цепь, поглощающую кислород гораздо быстрее, чем делает это «каноническая» цепь, составленная из комплексов I, III и IV. Простая цепь, получившая название цепи дыхательной защиты, состоит всего из двух ферментов: 1) несопряженной NADH-дегидрогеназы II с ее единственным редокс-центром (FAD), которая восстанавливает CoQ посредством NADH, и 2) bd-хинолоксидазы, окисляющей полученный C0QH2 кислородом. Эта вторая реакция генерирует протонный потенциал с эффективностью №/е -= 1, т. е. вдвое меньшей, чем у комплекса IV. В итоге цепь дыхательной защиты транспортирует всего 2Н+ на каждую молекулу окисляемого NADH вместо 10Н+ в случае «канонической» цепи. Следовательно, азотобактеру в условиях дыхательной защиты приходится окислять в 5 раз больше NADH, чтобы получить столько же АТФ, сколько синтезирует обычная дыхательная цепь.
Читать дальшеИнтервал:
Закладка:







