Владимир Скулачёв - Жизнь без старости
- Название:Жизнь без старости
- Автор:
- Жанр:
- Издательство:МГУ им. М.В.Ломоносова
- Год:2014
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Владимир Скулачёв - Жизнь без старости краткое содержание
Не исключено, что это только начало пути, и уже в ближайшие годы будет создан препарат, предохраняющий от старости. Чтобы дожить до этого будущего, авторы предлагают 7 принципов, выведенных на основе биологического проникновения в глубинную природу человека. Каждый из принципов понятен и достаточно легко выполним, если вами движет любовь к жизни и своим близким. Следуя этим принципам, можно замедлить генетическую программу старения и заставить свой организм думать, что ему рано стареть.
Прочитайте, приблизьтесь к фонтану молодости — и живите долго!
Жизнь без старости - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Как показано на рис. П-3.1, последовательность реакций дыхательной цепи начинается окислением NADH. В процессе участвует несколько редокс-центров NADH-CoQ-редуктазного комплекса: FMN и группа [Fe-S] кластеров. NADH-CoQ-редуктаза восстанавливает C0Q.
Полученный C0QH2 окисляется системой Q-цикла, включающей [Fe-S] кластер комплекса III (Fe-SIII Риске), цитохром с1 и два гема цитохрома b (высокопотенциальный Ьн и низкопотенциальный Ьь).
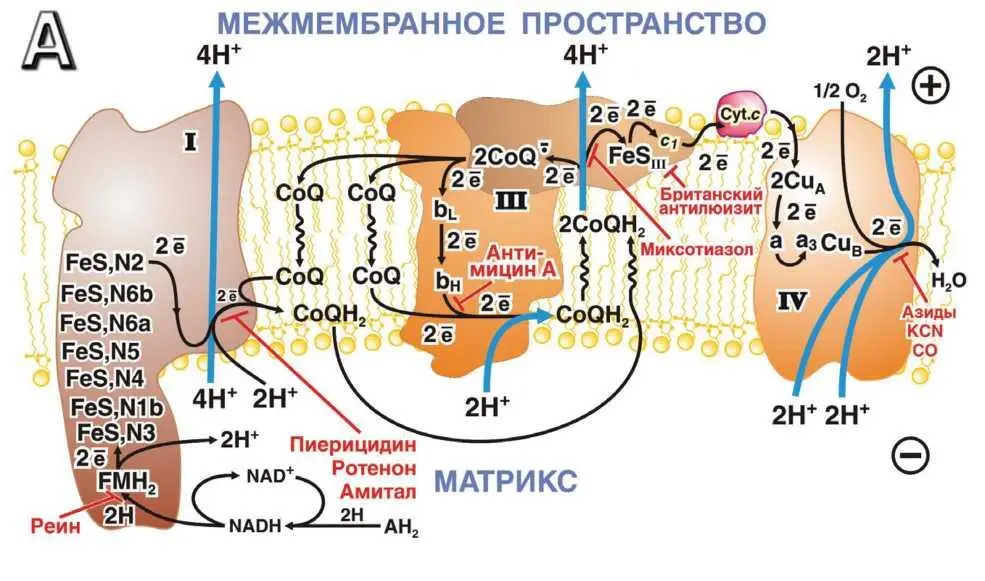
Рис. П-3.1.Схема дыхательной цепи митохондрий человека. Ингибиторы ферментов дыхательной цепи показаны красным цветом [444].
Непосредственным акцептором электронов для C0QH2 служит Fe-SIII. От Fe-SIII электроны поступают на цитохром cl и далее на цитохром с. Последний используется как восстановитель конечного фермента дыхательной цепи — цитохромоксидазы, имеющей в своем составе два гема (а и аз) и три атома меди. Цитохромоксидаза восстанавливает кислород до воды. Процесс окисления одной молекулы NADH кислородом сопряжен с переносом 10 протонов из митохондриального матрикса (у бактерий — из цитоплазмы) в межмембранное пространство митохондрий (у грамотрицательных бактерий — в периплазму, а у грамположительных — во внешнюю среду). Образованный мембранный потенциал далее расходуется на синтез АТФ при помощи так называемого комплекса V (протонной АТФ-синтазы) либо на совершение некоторых других типов полезной работы.
Описанное выше многокомпонентное устройство дыхательной цепи, помимо обеспечения высокой стехиометрии Н+/О 2, имеет еще ряд дополнительных преимуществ. Прежде всего, это придает ей известную гибкость в использовании субстратов с разными окислительновосстановительными потенциалами. Восстановительные эквиваленты могут поступать в дыхательную цепь на различных ее уровнях в зависимости от редокс-потенциала окисляемого субстрата. Если этот потенциал оказывается меньше, равен или лишь немногим больше -320 мВ (редокс-потенциал пары NADH/NAD+), то в окислении такого субстрата может участвовать вся дыхательная цепь. Именно так окисляется большинство субстратов дыхания. Если редокс-потенциал субстратов окисления намного отрицательней такового пары NADH/NAD+, то в систему переноса электронов может быть включен специальный механизм накопления энергии еще до дыхательной цепи. Такого типа реакции относят к разряду процессов трансформации энергии на уровне субстрата, или субстратного фосфорилирования. Если редокс-потенциал субстрата значительно более положительный, чем у пары NAD+/NADH, то восстановительные эквиваленты с такого субстрата переносятся на средний или конечный участок дыхательной цепи. Так окисляется один из субстратов цикла Кребса — сукцинат (редокс-потенциал +30 мВ), а также ацил-СоА — субстрат первой оксидоредукции в системе β-окисления жирных кислот. И сукцинат, и ацил-СоА-дегидрогеназы подают электроны в дыхательную цепь, минуя комплекс I, т. е. переносят электроны сразу на убихинон. В очень редких случаях редокс-потенциал окисляемого субстрата более положителен, чем даже у C0Q. Тогда восстановительные эквиваленты входят в цепь на уровне цитохрома с, так что только цитохромоксидазный генератор участвует в трансформации энергии. Примером может служить окисление аскорбиновой кислоты у животных или окисление метанола, ионов Fe 2+ или нитрита у различных бактерий.
Приложение 4. Активные формы кислорода. Природа АФК и пути их образования в клетке
Почти весь кислород, поглощаемый живыми организмами, превращается в воду. Это происходит в результате реакции молекулы О 2с 4e -и 4H+. Однако небольшая доля поглощенного О 2, обычно не превышающая 12 %, дает вместо воды анион супероксида (одноэлектронное восстановление О 2до радикала О 2·-) или Н 2О 2(двухэлектронное восстановление О 2до аниона пероксида O 2 2-). Этот, казалось бы, незначительный в общем балансе дыхания процесс играет важнейшую роль в регуляции физиологических функций организма и даже его судьбе. Дело в том, что анион супероксида и Н 2О 2могут превращаться в АФК, а именно в радикалы либо пергидроксила (НО 2·), либо гидроксила (ОН·), а также в пероксинитрит (ONOO-), способный давать радикал ·ONOO, синглетный кислород ( 1O2) или все тот же ОН· (рис. П-4.1).
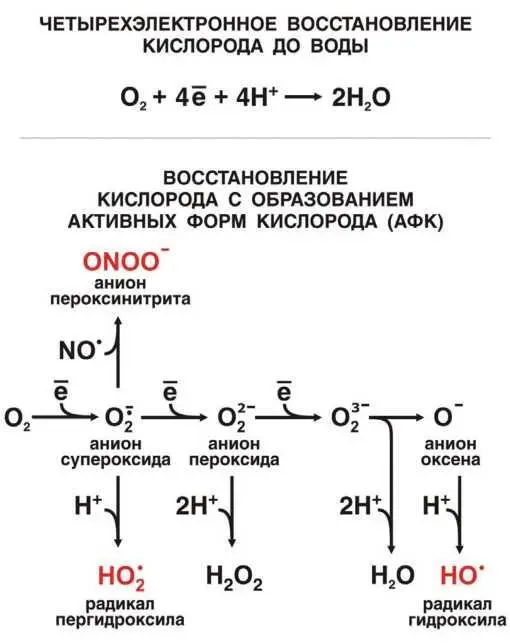
Рис. II-4.1Образование активных форм кислорода.
В свою очередь, АФК атакуют самые различные компоненты клетки, включая ДНК, РНК, белки и липиды. Некоторые из АФК настолько агрессивны как окислители, что даже небольшой их доли в общем потреблении кислорода хватает для проявления вредоносного действия, последствия которого могут оказаться трагическими для митохондрии, клетки и даже для организма в целом. Ведь если 1 % от тех 400 л О 2, которые поглощает в день взрослый человек среднего веса, пойдут на образование не воды, а АФК, то это будет означать продукцию 4 л супероксида в день. Нетрудно представить себе последствия, если учесть, что такой продукт дальнейшего превращения супероксида как радикал гидроксила может соперничать по токсичности с «хлоркой», применяемой при дезинфекции. Первоначально считалось, что образование АФК — неизбежная «расплата» за аэробный образ жизни, поскольку мелкие, незаряженные и довольно гидрофобные молекулы О 2, свободно проникающие через мембраны и даже накапливающиеся в них, чисто химически (неферментативно) могут окислять редокс-группы коферментов и белков, способные к одноэлектронному восстановлению кислорода. К таким группам относят полувосстановленные (семихинонные) формы убихинона, пластохинона, менахинона, флавинов, а также [Fe-Sj-кластеры негемовых железопротеидов с редокс-потенциалами, близкими к таковому пары супероксид/кислород. Однако многочисленные публикации последних лет убедительно свидетельствуют о том, что если даже АФК и служат побочными продуктами метаболизма, то, тем не менее, их образование и уборка тщательно контролируются организмом. В результате концентрация АФК в организме может варьировать на порядки за счет работы специальных регулирующих систем.
В случае наиболее мощных генераторов АФК, таких как комплексы I и III дыхательной цепи (а также комплекса II, дегидрогеназы дигидролипоата и цитохрома Р450), образование O 2 -выглядит как «преждевременная утечка» электронов, которые вместо переноса по дыхательной цепи (или применительно к цитохрому Р450 — участия в оксигенации субстрата) захватываются кислородом в процессе его одноэлектронного восстановления. Ввиду колоссальных объемов кислорода, поглощаемых дыхательной цепью, даже очень небольшая их «утечка» должна привести к образованию таких количеств АФК, которые значительно больше тех, что генерируются ферментами, специализированными на восстановлении О 2до O 2 -или Н 2О 2, т. е. моноаминооксидазой внешней митохондриальной мембраны, NADPH-оксидазой плазмалеммы, оксидазами пероксисом, ксантиноксидазой и некоторыми другими ферментными системами (таблица П-4.1).
Читать дальшеИнтервал:
Закладка:







