Владимир Скулачёв - Жизнь без старости
- Название:Жизнь без старости
- Автор:
- Жанр:
- Издательство:МГУ им. М.В.Ломоносова
- Год:2014
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Владимир Скулачёв - Жизнь без старости краткое содержание
Не исключено, что это только начало пути, и уже в ближайшие годы будет создан препарат, предохраняющий от старости. Чтобы дожить до этого будущего, авторы предлагают 7 принципов, выведенных на основе биологического проникновения в глубинную природу человека. Каждый из принципов понятен и достаточно легко выполним, если вами движет любовь к жизни и своим близким. Следуя этим принципам, можно замедлить генетическую программу старения и заставить свой организм думать, что ему рано стареть.
Прочитайте, приблизьтесь к фонтану молодости — и живите долго!
Жизнь без старости - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Механизм борьбы с недорепликацией был открыт в середине 1980х годов, когда обнаружилось, что в клетках одноклеточного организма тетрахимены присутствует фермент, способный наращивать теломерные участки ДНК [109]. Этот фермент, названый впоследствии теломеразой, представляет собой РНК-белковый комплекс, обладающей обратной транскриптазной активностью: для синтеза теломерной ДНК он
использует в качестве матрицы связанную с ферментом молекулу РНК, последовательность которой соответствует таковой теломерных повторов [110]. Дальнейшие исследования показали, что ген теломеразы присутствует во всех изученных эукариотических организмах.
Практически в то же время появились и первые экспериментальные подтверждений гипотезы Оловникова об укорочении теломер в процессе старения. Оказалось, что длина теломер в сперматозоидах человека заметно превышает таковую в соматических клетках взрослого организма [61]. Ряд последовавших за этим открытием экспериментов подтвердил связанное с делением клеток уменьшение длины теломер в фибробластах, клетках крови, кишечника и ряда других тканей (см. обзор [9]). Эти результаты указывали на неспособность соматических клеток человека поддерживать в процессе деления длину теломер, в отличие от клеток зародышевой линии. Также подтвердил этот вывод и тот факт, что у человека экспрессия теломеразы и теломеразная активность наблюдается только в половых клетках, клетках эмбриональной ткани и стволовых клетках [7]. (Однако у некоторых животных, в том числе у мышей, крыс [48,267,64,108], кур [369] и лягушек [24] некоторая теломеразная активность наблюдается и в соматических клетках).
Решающее значение для доказательства роли теломеразы в обеспечении неограниченного репликативного потенциала сыграли эксперименты, в которых ген этого фермента был активирован в культуре соматических клеток человека [20,368]. Оказалось, что теломеразная активность позволяла клеткам в культуре преодолеть предел Хейфлика и продолжать делиться. Скорость укорочения теломер зависит от многих факторов, и клеточное деление — лишь один из них. Здесь следует отметить, что теломеры и при делении клетки обычно укорачиваются значительно сильнее, чем можно было бы предполагать исходя только из феномена недорепликации: за одно деление соматических клеток человека теломеры уменьшаются на 20-200 нуклеотидных пар [132].
Оказалось, что важной причиной укорочения теломер является стресс, прежде всего окислительный. ДНК теломер особенно подвержена повреждениям, т. к. комплекс связанных с теломерами белков предположительно мешает доступу ферментов репарации [371,145]. Для человека показана достоверная отрицательная корреляция между уровнем стресса и длиной теломер [88]. Также было установлено, что у людей регулярная физическая нагрузка коррелирует с более медленным укорочением теломер [174,247].
Сокращение длины теломер ниже определенного предела приводит к остановке клеточного деления. Происходит это, однако, не из-за постепенного «съедания» кодирующей области ДНК вследствие недорепликации. Минимальная длина теломер в клетках человеческого организма составляет около 500 пар оснований [7]. Показано также, что длина теломер, начиная с которой дальнейшее укорочение приводит к нестабильности генома, слиянию хромосом и иным аномалиям, составляет примерно 13 теломерных повторов (около 100 пар оснований) [42].
Механизм остановки клеточного деления при достижении определенной, минимальной длины теломер до конца не ясен, и включает много факторов, среди которых важнейшую роль играет «страж генома» — белок p53, а также белки p21, p16INK4A и pRb (рис. П-5.1) [306]. Все они являются ключевыми регуляторами клеточного ответа на разные виды стресса (в том числе на повреждение ДНК) и в защите от трансформации клетки в раковую.
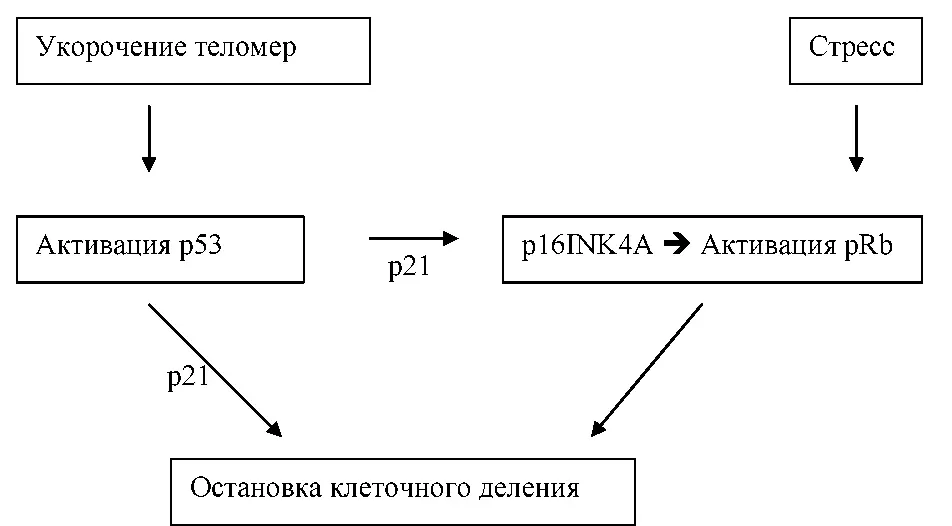
Рис. II-5.1.Гипотетическая схема механизма остановки клеточного деления в ответ на укорочение теломер (адаптировано из M. Shawi, C. Autexier [306]).
Ограничение клеточного деления, не допускающее бесконтрольную пролиферацию и рак, является, по-видимому, одной из основных функций сокращения теломер в соматических клетках in vivo [7]. На это указывает экспрессия теломеразы и присутствие теломеразной активности в клетках более чем 90 % раковых опухолей (см. также обзор [307]). Эксперименты на мышах выявили, что потеря теломеразной активности (при условии нормального уровня активности белка p53) повышала устойчивость животных к раковым заболеваниям [216]. Существенно, что вероятность возникновения рака в пересчете на одну
клетку у мышей и крыс (экспрессирующих теломеразу в соматических клетках) на порядки выше, чем у человека.
Вскоре после открытия предела Хейфлика появились теории «клеточного старения», объяснявшие феномен падения жизненных функций организма с возрастом снижением репликативного потенциала его клеток. Исследования теломер и теломеразы дали объяснение феномену предела Хейфлика, что вызвало рост интереса к этому ферменту со стороны медиков и геронтологов. Было выяснено, что у человека дефект даже в одном из аллелей генов теломеразы приводит к патологиям, из которых наиболее распространен врожденный дискератоз. Причиной этого вероятно является жесткая регуляция экспрессии теломеразы (как ее белкового, так и РНК-компонента) [7].
Кроме того, была выявлена корреляция между чрезмерно укороченными теломерами и частотой ряда возраст-зависимых заболеваний [7]. Одной из наиболее ярких работ по роли теломеразы в процессе старения стали эксперименты, в которых с помощью суперэкспрессии теломеразы была увеличена продолжительность жизни мышей, при условии одновременного усиления антираковой защиты [357]. Следует отметить, что наличие компромисса между защитой от рака и замедлением старения есть не только в случае теломеразы. Другим известным примером является белок p53, который с одной стороны является ключевым звеном антираковой защиты, а с другой — ускоряет старение [365].
Не менее удивительные результаты были получены в группе Марии Бласко: исследователям удалось замедлить старение и продлить жизнь у взрослых мышей с помощью повышения уровня экспрессии теломеразы [15]. Немаловажно, что в этой работе «теломеразная генная терапия», осуществлявшаяся с помощью обработки животных аденоассоциированным вирусом, оказалась эффективной не только для взрослых (1 год), но и для старых (2 года) мышей: медианная продолжительность жизни после обработки вирусов возросла на 24 % и на 13 % соответственно. Примечательно, что при этом терапия не привела к увеличению частоты возникновения злокачественных образований [15].
Читать дальшеИнтервал:
Закладка:







