БСЭ БСЭ - Большая Советская Энциклопедия (СТ)
- Название:Большая Советская Энциклопедия (СТ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (СТ) краткое содержание
Большая Советская Энциклопедия (СТ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Идеальный газ.Простейшим объектом исследования С. ф. является идеальный газ, т. е. газ настолько разреженный, что можно пренебречь взаимодействием между его молекулами. Термодинамические функции такого газа можно вычислить до конца. Энергия газа равна просто сумме энергий отдельных молекул. Этого, однако, ещё недостаточно, чтобы считать молекулы полностью независимыми. Действительно, в квантовой механике, даже если силы взаимодействия между частицами отсутствуют, существует определённое влияние одинаковых (тождественных) частиц друг на друга, если они находятся в близких квантовомеханических состояниях. Это т. н. обменное взаимодействие . Им можно пренебречь, если на одно состояние приходится в среднем много меньше одной частицы, что во всяком случае имеет место при достаточно высокой температуре газа; такой газ называется невырожденным. Фактически обычные газы, состоящие из атомов и молекул, невырождены при всех температурах (при которых они ещё газообразны). Для невырожденного идеального газа функция распределения распадается на произведение функций распределения для отдельных молекул. лежат в интервалах dp x , dp y , dp z , а координаты — в интервалах dx , dy , dz :
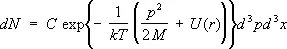 , (12) Энергия молекулы одноатомного газа во внешнем поле с потенциальной энергией U ( r ) равна p 2/2M + U ( r ). Интегрируя (6) по координатам r ( x, у, z ) и импульсам р ( р х , p y , p z ) всех молекул, кроме одной, можно найти число молекул dN , импульсы которых
, (12) Энергия молекулы одноатомного газа во внешнем поле с потенциальной энергией U ( r ) равна p 2/2M + U ( r ). Интегрируя (6) по координатам r ( x, у, z ) и импульсам р ( р х , p y , p z ) всех молекул, кроме одной, можно найти число молекул dN , импульсы которых
где d 3p = dp xdp ydp z , d 3x = dxdydz . Эта формула называется распределением Максвелла — Больцмана (см. Больцмана статистика ). Если проинтегрировать (12) по импульсам, то получится формула для распределения частиц по координатам во внешнем поле, в частности в поле тяготения — барометрическая формула . Распределение же по скоростям в каждой точке пространства совпадает с Максвелла распределением .
Статистическая сумма идеального газа также распадается на произведение одинаковых членов, соответствующих отдельным молекулам. Для одноатомного газа суммирование в (8) сводится к интегрированию по координатам и импульсам, т. е. сумма заменяется на интеграл по 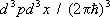 3 в соответствии с числом ячеек [с объёмом
3 в соответствии с числом ячеек [с объёмом 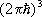 ] в фазовом пространстве одной частицы. Свободная энергия N атомов газа равна:
] в фазовом пространстве одной частицы. Свободная энергия N атомов газа равна:
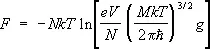 ,
,
где g — статистический вес основного состояния атома, т. е. число состояний, соответствующее его нижнему энергетическому уровню, V — объём газа (здесь е — основание натуральных логарифмов). При высоких температурах g = ( 2J + 1 )( 2L + 1 ), где J — величина спина , a L — момента орбитального атома (в единицах 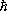 ). Из выражения для свободной энергии следует, что уравнение состояния идеального газа, т. е. зависимость его давления ( Р ) от плотности числа частиц ( N/V ) и температуры, имеет вид: PV = NkT . Внутренняя энергия одноатомного газа и его теплоёмкость при постоянном объёме оказываются равными:
). Из выражения для свободной энергии следует, что уравнение состояния идеального газа, т. е. зависимость его давления ( Р ) от плотности числа частиц ( N/V ) и температуры, имеет вид: PV = NkT . Внутренняя энергия одноатомного газа и его теплоёмкость при постоянном объёме оказываются равными:
Е = 3/ 2( NkT ), C v= 3/ 2 Nk , (13)
а его химический потенциал:
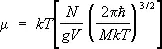 . (14)
. (14)
Характерно, что даже для невырожденного (т. е. с достаточной точностью подчиняющегося классической механике) газа выражения для свободной энергии и химического потенциала содержат постоянную Планка 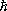 . Это, в конечном счёте, обусловлено отмеченной ранее связью энтропии с понятием числа квантовых состояний.
. Это, в конечном счёте, обусловлено отмеченной ранее связью энтропии с понятием числа квантовых состояний.
В случае двухатомных и многоатомных газов вклад в термодинамические функции вносят также колебания и вращение молекул. Этот вклад зависит от того, существенны ли эффекты квантования колебаний и вращения молекулы. Расстояние между колебательными уровнями энергии имеет порядок 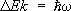 , где w — характерная частота колебаний, а расстояние между первыми вращательными уровнями энергии порядка
, где w — характерная частота колебаний, а расстояние между первыми вращательными уровнями энергии порядка 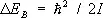 , где I — момент инерции вращающегося тела, в данном случае молекулы. Классическая статистика справедлива, если температура достаточно высока, так что
, где I — момент инерции вращающегося тела, в данном случае молекулы. Классическая статистика справедлива, если температура достаточно высока, так что
kT >> D E .
В этом случае в соответствии с законом равнораспределения вращение вносит в теплоёмкость постоянный вклад, равный 1/ 2 k на каждую вращательную степень свободы; в частности, для двухатомных молекул этот вклад равен k . Колебания же вносят в теплоёмкость вклад, равный k на каждую колебательную степень свободы (так что колебательная теплоёмкость двухатомной молекулы равна k ). Вдвое больший вклад колебательной степени свободы по сравнению с вращательной связан с тем, что при колебаниях атомы в молекуле имеют не только кинетическую, но и потенциальную энергию. В обратном предельном случае 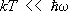 молекулы находятся в своём основном колебательном состоянии, энергия которого не зависит от температуры, так что колебания вообще не вносят вклада в теплоёмкость. То же относится к вращению молекул при условии
молекулы находятся в своём основном колебательном состоянии, энергия которого не зависит от температуры, так что колебания вообще не вносят вклада в теплоёмкость. То же относится к вращению молекул при условии 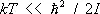 . По мере повышения температуры появляются молекулы, находящиеся в возбуждённых колебательных и вращательных состояниях, и эти степени свободы начинают давать вклад в теплоёмкость — как бы постепенно «включаются», стремясь при дальнейшем повышении температуры к своему классическому пределу. Т. о., учёт квантовых эффектов позволил объяснить экспериментально наблюдаемую зависимость теплоёмкости газов от температуры. Значения величины
. По мере повышения температуры появляются молекулы, находящиеся в возбуждённых колебательных и вращательных состояниях, и эти степени свободы начинают давать вклад в теплоёмкость — как бы постепенно «включаются», стремясь при дальнейшем повышении температуры к своему классическому пределу. Т. о., учёт квантовых эффектов позволил объяснить экспериментально наблюдаемую зависимость теплоёмкости газов от температуры. Значения величины 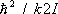 , характеризующей «вращательный квант», для большинства молекул порядка нескольких градусов или десятков градусов (85 К для H 2, 2,4 К для O 2, 15 К для HCl). В то же время характерные значения величины
, характеризующей «вращательный квант», для большинства молекул порядка нескольких градусов или десятков градусов (85 К для H 2, 2,4 К для O 2, 15 К для HCl). В то же время характерные значения величины 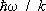 для «колебательного кванта» порядка тысяч градусов (6100 К для H 2, 2700 К для O 2, 4100 К для HCl). Поэтому вращательные степени свободы включаются при гораздо более низких температурах, чем колебательные. На рис. 1 изображены температурная зависимость вращательной (а) и колебательной (б) теплоёмкостей для двухатомной молекулы (вращательная теплоёмкость построена для молекулы из разных атомов).
для «колебательного кванта» порядка тысяч градусов (6100 К для H 2, 2700 К для O 2, 4100 К для HCl). Поэтому вращательные степени свободы включаются при гораздо более низких температурах, чем колебательные. На рис. 1 изображены температурная зависимость вращательной (а) и колебательной (б) теплоёмкостей для двухатомной молекулы (вращательная теплоёмкость построена для молекулы из разных атомов).
Интервал:
Закладка:
