Полина Лосева - Против часовой стрелки. Что такое старение и как с ним бороться
- Название:Против часовой стрелки. Что такое старение и как с ним бороться
- Автор:
- Жанр:
- Издательство:Альпина нон-фикшн
- Год:2020
- Город:Москва
- ISBN:978-5-0013-9314-6
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Полина Лосева - Против часовой стрелки. Что такое старение и как с ним бороться краткое содержание
В своей книге биолог и научный журналист Полина Лосева выступает в роли адвоката современной науки о старении и рассказывает о том, чем сегодня занимаются геронтологи и как правильно интерпретировать полученные ими результаты. Кто виноват в том, что мы стареем? Что может стать нашей защитой от старости: теломераза или антиоксиданты, гормоны или диеты? Биологи пока не пришли к единому ответу на эти вопросы, и читателю, если он решится перейти от размышлений к действиям, предстоит сделать собственный выбор.
Эта книга станет путеводителем по современным теориям старения не только для биологов, но и для всех, кому интересно, как помочь своему телу вести неравную борьбу со временем.
Против часовой стрелки. Что такое старение и как с ним бороться - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
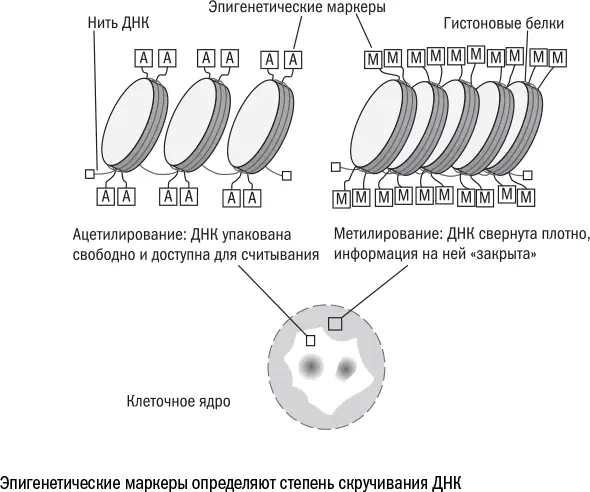
За сворачивание ДНК отвечают ферменты метилтрансферазы: они навешивают на определенные участки генов метки (метильные группы), которые делают эти участки более липкими, то есть фактически работают как скотч, клейкая лента. Помеченные области ДНК прочно слипаются друг с другом, и считать с них информацию у клетки уже не выйдет. Переход генов из "активных" в "молчащие" и наоборот называют эпигенетическими изменениями (в отличие от наследственных, генетических изменений в самой последовательности ДНК), а метки на ДНК – эпигенетическими маркерами.
Главные перестройки генов происходят, когда клетка получает свою профессию и выбирает, какие из них "закрыть". Поэтому в ядре стволовой клетки гораздо больше раскрученной ДНК, чем у терминально дифференцированной. Но даже зрелая клетка-профессионал в течение жизни продолжает понемногу сворачивать ДНК [203] Zhang R. et al. Formation of macroH2A-containing senescence-associated heterochromatin foci and senescence driven by ASF1a and HIRA // Developmental Cell. 2005 Jan; 8 (1): 19–30.
, и иногда сенесцентные клетки можно вычислить [204] Muñoz-Espín. D. & Serrano M. Cellular senescence: from physiology to pathology // Nature Reviews Molecular Cell Biology. 2014 Jun; 15: 482–496.
просто по количеству скрученной ДНК.
Одновременно с этим идет и другой процесс – раскручивание старых клубков ДНК. По мере того как вслед за школьными учебниками на антресоль постепенно отправляются и другие полезные книги, из старых чуланов выползает давно забытая рухлядь, занимает место на столе и пылит на всю квартиру. Так, с возрастом раскручиваются [205] Tsurumi A. & Li W. Global heterochromatin loss // Epigenetics. 2012 Jul; 7 (7): 680–688.
участки ДНК со спрятанными ретротранспозонами, о которых мы говорили в предыдущей главе. Безумный ксерокс выходит на свободу и начинает размножаться, повреждая те гены, которые еще доступны клетке.
Таким образом, клеточная жизнь сопровождается крупными переупаковками в ядре: одни участки ДНК сворачиваются, другие разворачиваются. Это связано с тем, что в клетке есть несколько типов метилтрансфераз: одни отвечают за поддержание старых эпигенетических маркеров, другие – за навешивание новых. С возрастом соотношение их активности меняется: первые расслабляются, а вторые, напротив, усиливают свои позиции. Поэтому опознать старую клетку можно не только по ее способностям и немощам, но и по тому, какие части ее ДНК активны, а какие, напротив, "молчат" – то есть по набору эпигенетических маркеров.
Потеря памяти
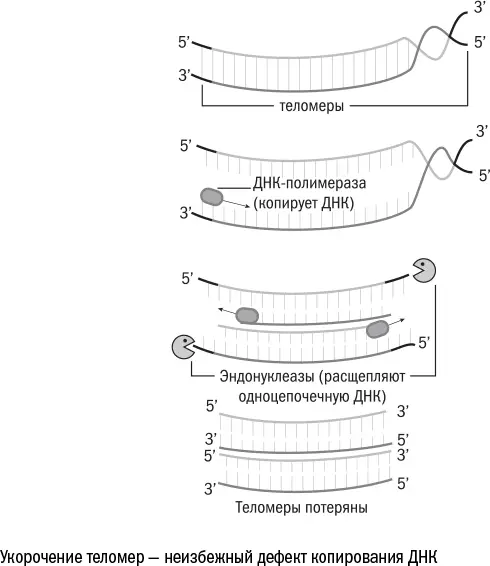
С возрастом ДНК не просто перестраивается, но и становится короче. Каждая из 46 наших хромосом – это отдельная нить, по краям которой находятся особые участки – теломеры. При каждом делении клетки небольшой кусочек теломер теряется. Это связано с тем, что полимеразы – белки, которые копируют ДНК, – не могут начать строить вторую цепочку с самого края, им необходимо сначала закрепиться и взять разгон. Поэтому они садятся на "затравочную" молекулу РНК, которая позже исчезает, а самый кончик молекулы, на который крепилась РНК, остается неудвоенным. Одиночные цепи ДНК в клетке долго не живут: их распознает система противовирусной защиты, принимая за кусок чужеродного генома, и уничтожает. Так хромосома становится короче.
В этом нет большой беды именно потому, что на концах хромосом находятся теломеры – набор бессмысленных повторов, которые не несут генетической информации. Они нужны как раз для того, чтобы их терять. Но после определенного количества делений теломеры заканчиваются, и под угрозой исчезновения при копировании оказываются настоящие, "содержательные" гены. В этот момент клетка перестает размножаться, чтобы не лишиться ценной информации и не наплодить потомков-мутантов, – и становится сенесцентной.
Этот феномен, еще не зная ничего о роли теломер, впервые описал [206] Hayflick L. The limited in vitro lifetime of human diploid cell strains // Experimental Cell Research. 1965 Mar; 37 (3): 614–636.
Леонард Хейфлик. Он обнаружил, что даже активно размножающиеся клетки теряют эту способность примерно после 50 раундов деления. Это пороговое значение получило название предела Хейфлика . То есть за 50 циклов размножения теломеры становятся критически короткими и клетка стареет. Поэтому клеточный возраст можно оценивать и по длине теломер. Чем быстрее клетка перестает размножаться, тем короче у нее были изначально теломеры и, следовательно, тем старше она была на момент старта эксперимента.
Однако потеря теломер – это не просто возрастное изнашивание ДНК. У клетки есть способы справиться с укорочением хромосом (подробнее об этом мы поговорим в главе "Виноват рак"), но чаще всего она их не применяет. Дело в том, что остановка деления – это еще один защитный механизм. Защищается таким образом клетка все от того же – от рака. Ведь если дать клеткам возможность размножаться бесконечно, то вместе со здоровыми клетками будут делиться и мутантные, и придется иметь дело уже не с одной опухолевой клеткой, а с целой колонией.
Бабушкин чулан
Следующим признаком старения должно было стать накопление внутриклеточного мусора. Однако использовать его как маркер старости довольно трудно. Проблема в том, что большинство поломок в клетках индивидуально. "Все счастливые семьи похожи друг на друга, каждая несчастливая семья несчастлива по-своему" – мы знаем, как должны выглядеть "здоровые", нетронутые клеточные молекулы, но предугадать, в каком именно месте какая из них сломается, практически невозможно.
Исключение составляют разве что "пигменты старения", например липофусцин [207] Jung T., Höhn A., Grune T. Lipofuscin: detection and quantification by microscopic techniques. // Methods in Molecular Biology. 2010; 594: 173–193.
– комок из перекрестно сшитых белков. Он выглядит как желто-коричневые гранулы, которые легко рассмотреть в микроскоп. Правда, не во всех клетках человека его можно обнаружить. Зато его аналоги встречаются и у довольно далеких от нас животных, например круглого червя [208] Pincus Z., Mazer T. C., Slack F. J. Autofluorescence as a measure of senescence in C. elegans : look to red, not blue or green // Aging. 2016 May; 8 (5): 889–898.
Caenorhabditis elegans , что позволяет изучать старение на клеточном уровне и у него.
В остальных случаях искать конкретные типы поломок в клетках – задача неблагодарная. И исследователи ориентируются обычно на косвенные признаки: работу клеточных систем по уборке мусора. Это может быть, например, аутофагия, то есть самопоедание. Чтобы переварить крупные скопления белков или целые органеллы, клетка окружает их мембранным пузырьком – вакуолью – и впрыскивает внутрь пищеварительные ферменты. Так клетки с возрастом заполняются прозрачными мембранными пузырьками. Правда, их наличие свидетельствует только о том, что клетка занималась уборкой у себя внутри, и ничего не говорит о том, одерживает ли она победу над мусором или уже готова сдаться.
Читать дальшеИнтервал:
Закладка:










