Полина Лосева - Против часовой стрелки. Что такое старение и как с ним бороться
- Название:Против часовой стрелки. Что такое старение и как с ним бороться
- Автор:
- Жанр:
- Издательство:Альпина нон-фикшн
- Год:2020
- Город:Москва
- ISBN:978-5-0013-9314-6
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Полина Лосева - Против часовой стрелки. Что такое старение и как с ним бороться краткое содержание
В своей книге биолог и научный журналист Полина Лосева выступает в роли адвоката современной науки о старении и рассказывает о том, чем сегодня занимаются геронтологи и как правильно интерпретировать полученные ими результаты. Кто виноват в том, что мы стареем? Что может стать нашей защитой от старости: теломераза или антиоксиданты, гормоны или диеты? Биологи пока не пришли к единому ответу на эти вопросы, и читателю, если он решится перейти от размышлений к действиям, предстоит сделать собственный выбор.
Эта книга станет путеводителем по современным теориям старения не только для биологов, но и для всех, кому интересно, как помочь своему телу вести неравную борьбу со временем.
Против часовой стрелки. Что такое старение и как с ним бороться - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Именно на эти симптомы нацелены современные препараты против болезни Альцгеймера: они блокируют ферменты, расщепляющие ацетилхолин в мозге, и таким образом повышают его концентрацию. Но потерянные нейроны уже не вернуть, и человек постепенно теряет [355] Hayashi K. et al. Continuous intracerebroventricular injection of Porphyromonas gingivalis lipopolysaccharide induces systemic organ dysfunction in a mouse model of Alzheimer's disease // Experimental Gerontology. 2019 Jun; 120: 1–5.
контроль за собственным телом. Поэтому вслед за болезнью Альцгеймера часто тянутся и другие возрастные патологии вроде сердечной недостаточности или саркопении.
Болезнь Альцгеймера – далеко не единственная возможная причина нейродегенерации и деменции. В большой семье нейродегенеративных заболеваний несколько десятков разных патологий. Одни, такие как рассеянный склероз или боковой амиотрофический склероз – тот самый, которым болел Стивен Хокинг, начинаются с дегенерации и повреждения периферических нервов. Другие атакуют мозг напрямую – например, алкогольная энцефалопатия – и сразу вызывают деменцию. Болезнь Альцгеймера находится на перекрестке этих множеств, где нейродегенерация и деменция встречаются одновременно. Вместе с ней на этом перекрестке расположены болезнь Паркинсона, прионные заболевания и другие менее известные синдромы. Некоторые из них даже объединяют в себе несколько болезней разом, например западно-тихоокеанский комплекс [356] Spencer P. S., Kisby G. E., Ludolph A. C. Slow toxins, biologic markers, and long‐latency neurodegenerative disease in the western Pacific region // Neurology. 1991 May; 41 (5 Suppl 2): 62–66.
из паркинсонизма, деменции и бокового амиотрофического склероза (в соответствии с названием он встречается только на западном побережье Тихого океана, от Индонезии до Японии).
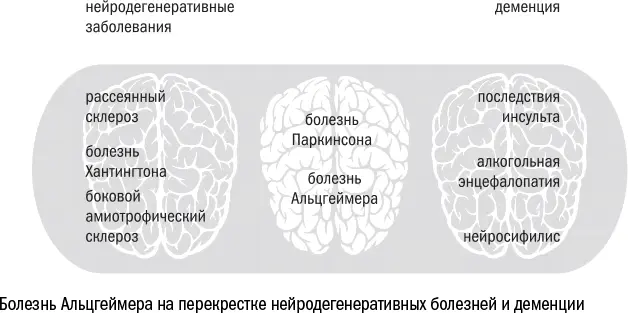
Все эти многочисленные болезни отличаются друг от друга несколькими особенностями. Во-первых, местом начала дегенерации. Болезнь Альцгеймера начинается, как правило, в нейронах гиппокампа (область мозга, отвечающая среди прочего за память), а стартовой точкой для болезни Паркинсона становятся клетки черной субстанции (область мозга, которая контролирует в основном моторику). От очага дегенерации зависит, как именно проявит себя деменция: в виде проблем со вниманием, памятью или настроением.
Второе важное отличие – в белках, которые возникают в клетках и межклеточном веществе. В ходе болезни Альцгеймера в тканях накапливается бета-амилоид и белок тау, при болезни Паркинсона – белки тау и альфа-синуклеин, многие другие виды деменции тоже сопровождаются отложением тау-белка.
Множество сочетаний "тип белка + пораженная область нервной системы" рождает целую палитру нейродегенеративных деменций. Вместе это семейство становится серьезной угрозой для человечества: по оценкам ВОЗ [357] Background Paper 6.11 Alzheimer Disease and other Dementias. https://www.who.int/medicines/areas/priority_medicines/BP6_11Alzheimer.pdf.
, сегодня деменцией страдает около 36 миллинонов человек в мире, а к 2050 году станет больше 115 миллионов, поскольку средняя продолжительность жизни неуклонно растет. Однако 60–70 % [358] https://www.who.int/news-room/fact-sheets/detail/dementia.
всех случаев деменции завоевала себе именно болезнь Альцгеймера, потеснив на этом фронте своих братьев и сестер.
Чем именно так примечательна болезнь Альцгеймера, до сих пор не вполне ясно. Возможно, дело во множестве факторов риска, которые усиливают вероятность того, что человек ею заболеет. Сегодня мы знаем столько этих факторов, что достоверно спрогнозировать развитие болезни невозможно. Среди них и возраст, и пол, и некоторые мутации, а еще гипертония, ожирение, синдром Дауна, травмы головного мозга и социальная пассивность. Ниже мы попробуем найти общую нить, которая связала бы с болезнью Альцгеймера каждый из них.
В начале были белки
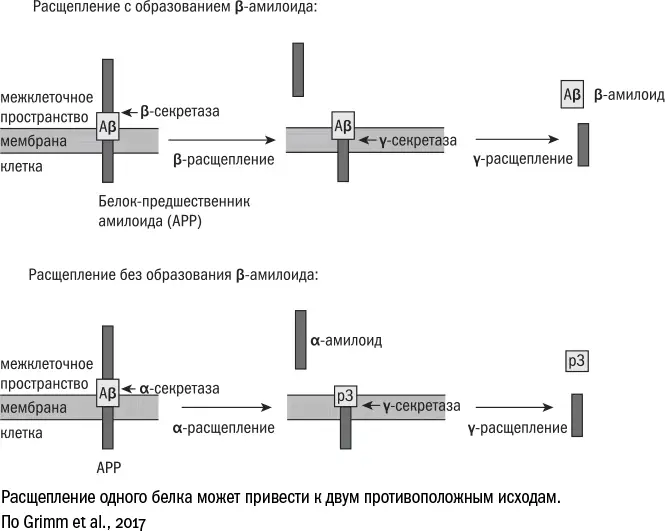
Каскад болезни Альцгеймера начинается с белка АРР (amyloid precursor protein). Он пронизывает мембраны многих клеток организма, например встречается даже в жировой ткани [359] An Y. A. & Scherer P. E. Targeting the amyloid precursor protein (APP) to mitochondria of white adipose tissues triggers mitochondrial dysfunction and obesity // Diabetes. 2018 Jul; 67 (Suppl 1).
, но больше всего его на нейронах. Точные функции АРР мы до сих пор представляем себе смутно. Судя по всему, основная роль этого белка – сигнальная. Время от времени ферменты α-секретаза (строго говоря, это не один фермент, а целая группа) и γ-секретаза (тоже большой молекулярный комплекс) отрезают [360] Grimm M. O. W., Mett J., Grimm H. S., Hartmann T. APP function and lipids: a bidirectional link // Frontiers in Molecular Neuroscience. 2017 Mar; 10: 63.
от АРР внеклеточную часть, которая уплывает в межклеточное пространство. Ее называют альфа-амилоидом, а служит она сообщением [361] Tyan S.-H. et al. Amyloid precursor protein (APP) regulates synaptic structure and function // Molecular and Cellular Neuroscience. 2012 Aug; 51 (1–2): 43–52.
для окружающих клеток: призывает стволовые клетки к дифференцировке и способствует образованию связей между нейронами. В общем, сам по себе белок АРР полезен и для клеток жизненно необходим. Даже коварные опухолевые клетки отказываются размножаться [362] Galvão F., Grokoski K. C., da Silva B. B., Lamers M. L., Siqueira I. R. The amyloid precursor protein (APP) processing as a biological link between Alzheimer's disease and cancer // Ageing Research Reviews. 2019 Jan; 49: 83–91.
, если отключить в них ген АРР.
Но иногда вместо α-секретазы за дело берется β-секретаза – похожий фермент, который разрушает молекулу АРР в другом месте. И когда γ-секретаза совершает последний надрез, от АРР отделяется бета-амилоид. Но, поскольку это не полноценный белок, а в некотором смысле "неправильный", он сворачивается не так, как внеклеточная часть АРР, и может вместо этого принимать самые разные формы. На поверхности бета-амилоида то и дело оказываются "липкие" части, которыми он соприкасается с другими молекулами и образует нерастворимые агрегаты – амилоиды, которые затем дорастают до крупных бляшек. В присутствии бета-амилоида нейроны постепенно гибнут, теряя связи друг с другом; смерть клеток провоцирует воспаление, а оно лишь усиливает нейродегенерацию.
Бета-амилоид может не только слипаться с другими частицами бета-амилоида, но и провоцировать [363] Nussbaum J. M., Seward M. E., Bloom G. S. Alzheimer disease. A tale of two prions // Prion. 2013 Jan; 7 (1): 14–19.
их "неправильное" сворачивание. Как только несколько молекул принимают характерную форму, они собираются в комок и стимулируют окружающие молекулы принять такую же форму и примкнуть к ним. Таким образом, бета-амилоид оказывается "заразен", а комки его распространяются по мозгу как снежный ком.
Заразным может оказаться и второй белок – примета болезни Альцгеймера: тау-белок [364] Clavaguera F., Hench J., Goedert M., Tolnay M. Invited review: Prion‐like transmission and spreading of tau pathology // Neuropathology and Applied Neurobiology. 2014 Nov; 41 (1): 47–58.
. Его основная функция – удерживать от распада клеточный скелет. Тау скрепляет "рельсы", по которым вещества путешествуют вдоль длинных отростков нейронов. Когда на клетку действует бета-амилоид или другие стрессовые факторы, на тау-белок навешивается фосфатная группа, чтобы разрушить и перестроить цитоскелет. Если таких фосфорилированных молекул тау становится много, они тоже слипаются и вызывают агрегацию соседей. Образуются нейрофибриллярные клубки – еще один снежный ком, только внутри клеток, а не снаружи.
Интервал:
Закладка:










