Полина Лосева - Против часовой стрелки. Что такое старение и как с ним бороться
- Название:Против часовой стрелки. Что такое старение и как с ним бороться
- Автор:
- Жанр:
- Издательство:Альпина нон-фикшн
- Год:2020
- Город:Москва
- ISBN:978-5-0013-9314-6
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Полина Лосева - Против часовой стрелки. Что такое старение и как с ним бороться краткое содержание
В своей книге биолог и научный журналист Полина Лосева выступает в роли адвоката современной науки о старении и рассказывает о том, чем сегодня занимаются геронтологи и как правильно интерпретировать полученные ими результаты. Кто виноват в том, что мы стареем? Что может стать нашей защитой от старости: теломераза или антиоксиданты, гормоны или диеты? Биологи пока не пришли к единому ответу на эти вопросы, и читателю, если он решится перейти от размышлений к действиям, предстоит сделать собственный выбор.
Эта книга станет путеводителем по современным теориям старения не только для биологов, но и для всех, кому интересно, как помочь своему телу вести неравную борьбу со временем.
Против часовой стрелки. Что такое старение и как с ним бороться - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
А вот попытки проверить, растут ли под действием ТА-65 теломеры, закончились неоднозначно [536] Salvador L., Singaravelu G., Harley C. B., Flom P., Suram A., Raffaele J. M. A natural product telomerase activator lengthens telomeres in humans: a randomized, double blind, and placebo controlled study // Rejuvenation Research. 2016 Dec; 19 (6): 478–484.
: исследователи заверяют, что теломеры в опытной группе длиннее, чем в контроле, но разброс значений настолько велик, что едва ли можно однозначно говорить об успехе. Хорошей новостью здесь можно считать тот факт, что ни в одном из исследований у участников не развивались опухоли, то есть препарат можно считать безвредным, во всяком случае в небольших дозах, и продолжать его тестировать.
Враг или друг
Давайте теперь попробуем разобраться, в каких отношениях на самом деле находятся старение и рак. С одной стороны, рак вызывает [537] Abdul-Aziz A. M. et al. Acute myeloid leukemia induces protumoral p16INK4a-driven senescence in the bone marrow microenvironment // Blood. 2019 Jan; 133 (5): 446–456.
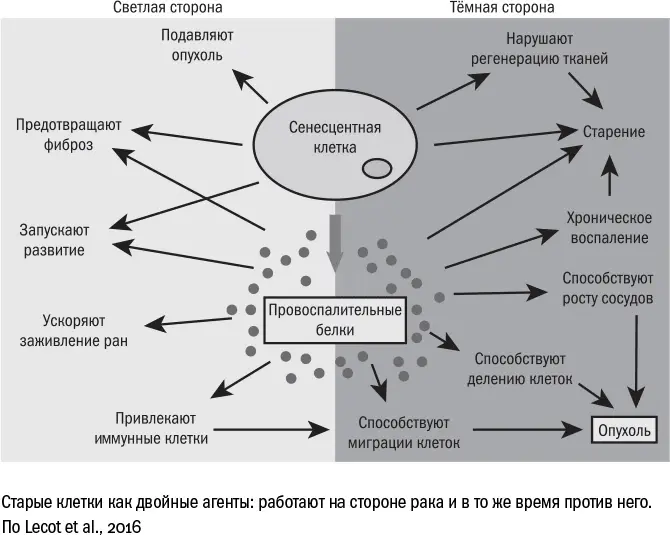
старение, устраивая клеткам стресс: выделяет токсины, отбирает у них еду, разрушает межклеточное вещество. Старость, в свою очередь, вызывает рак: сенесцентные клетки выделяют SASP и ослабляют защиту организма. Возникает замкнутый круг, как и во многих других возрастных болезнях. С другой стороны, в отличие от прочих болезней, старость служит не только стимулом для развития рака, но и защитой от него: именно для этого подозрительные клетки превращаются в сенесцентные на ранних стадиях под действием стресса или онкогенов или на поздних – через укорочение теломер.
Но если старение защищает от рака, то он не может быть возрастным заболеванием, одно исключает другое. И действительно, распространенность злокачественных опухолей падает после какого-то возрастного порога. Так, среди итальянских стариков 36 % страдают онкологическими заболеваниями [538] Pedesen J. et al. Declining cancer incidence at the oldest ages: Hallmark of aging or lower diagnostic activity? // Journal of Geriatric Oncology. 2019 Sep; 10 (5): 792–798.
в возрасте от 75 до 90 лет, но только 16 % – в возрасте от 100 до 106 лет. Объяснений этому факту можно придумать множество. Например, такое: чем старше человек, тем хуже диагностика – потому что организм и так напичкан болезнями или потому что люди не заинтересованы в болезненных процедурах для подтверждения диагноза. А может быть, случаев рака становится меньше, потому что в организме заканчивается почва для его развития: меньше стволовых клеток, хуже растут сосуды (в том числе из-за атеросклероза), ниже концентрации гормонов, стимулирующих деление клеток, зато сильнее воспаление и аутоиммунная агрессия лимфоцитов.
Но можно представить и другую картину: что все, кто мог пострадать от рака, уже погибли к 100 годам, а в живых остались только самые стойкие. Этот эффект отмечает [539] Bonafé et al. What studies on human longevity tell us about the risk for cancer in the oldest old: data and hypotheses on the genetics and immunology of centenarians // Experimental Gerontology. 2002 Oct – Nov; 37 (10–11): 1263–1271.
и Клаудио Франчески: среди итальянских долгожителей частота заболеваний раком и смертность от него ниже, чем в среднем по популяции, и кривая встречаемости рака с возрастом напоминает кривую смертности с характерным плато в конце. Кроме того, многие из долгожителей, по данным Франчески, когда-то уже болели раком, но смогли с ним справиться. И, учитывая, что в то время онкологическая медицина в Италии была развита хуже, чем сейчас, можно предположить, что их организм обладает какими-то особыми свойствами.
Так или иначе, защита от рака работает. Это хорошо видно на примере ускоренного старения. Например, у людей с синдромом Дауна опухоли образуются реже [540] Franceschi C. et al. Accelerated bio‐cognitive aging in Down syndrome: State of the art and possible deceleration strategies // Aging Cell. 2019 Feb; 18 (3): e12903.
, чем в среднем у их сверстников. У мышей [541] De la Rosa J. et al. Prelamin A causes progeria through cell-extrinsic mechanisms and prevents cancer invasion // Nature Communications. 2013 Aug; 4: 2268.
, которые служат моделью детской прогерии, опухоли возникают, но не расселяются по организму. А клетки людей, больных прогерией, вообще не удается [542] Fernandez P., Scaffidi P., Markert E., Lee J.-H., Rane S., Misteli T. Transformation resistance in a premature aging disorder identifies a tumor-protective function of BRD4 // Cell Reports. 2014 Oct; 9 (1): 248–260.
превратить в раковые в лабораторных условиях, какие онкогены в них ни запускай. Между старением и раком организм выбирает меньшее из двух зол, то, которое позволит ему дольше прожить в сложившихся условиях.
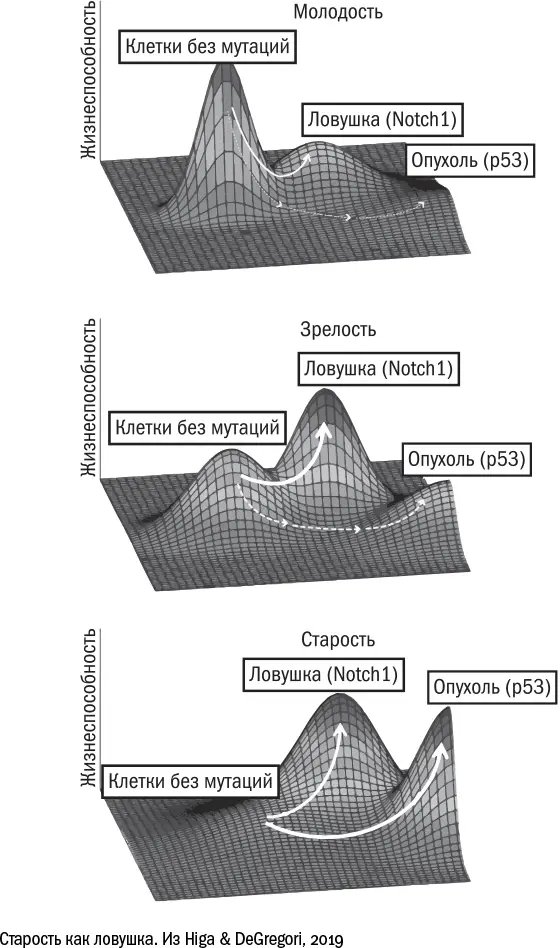
Лучше всего этот принцип иллюстрирует история [543] Higa K. C. & DeGregory J. Decoy fitness peaks, tumor suppression, and aging // Aging Cell. 2019 Mar; 18 (3): e12938.
с накоплением мутаций. Несколько исследователей независимо друг от друга заметили, что с возрастом в тканях начинают преобладать "хитрые мутации" – такие, которые не превращают клетку в опухоль, но делают ее жизнь немного проще. Например, мутация, которая разрушает ген Notch1 , позволяет клеткам пищевода не дифференцироваться (то есть не работать), а, следовательно, лучше размножаться. Соседям "хитрых" мутантов места для размножения не достается, и у них нет другого пути, кроме как дифференцироваться и работать за двоих. Это простой пример клеточной конкуренции, когда более "наглые" клетки фактически паразитируют на своих порядочных коллегах. В то же время для ткани в целом наглость оказывается вторым счастьем. Клетки с мутацией в Notch1 получают преимущество, захватывают ресурс и лишаются стимула эволюционировать дальше. Одержав промежуточную победу, они "успокаиваются" и не ищут новых высот. Вероятно, именно поэтому в них не появляются новые онкогенные мутации, например, в гене р53.
Таким образом, некоторые мутации для клеток оказываются ловушкой, дают им промежуточное превосходство и мешают двигаться вперед. Несмотря на то что сами по себе эти мутанты для тканей скорее вредны, чем полезны, в длительной перспективе это оказывается выигрышной стратегией. Другие механизмы клеточного старения – например, укорочение теломер – можно тоже представить себе в виде ловушки: попав в нее, клетка не приносит никому пользы, но и вреда от нее меньше, чем могло бы быть, останься она на плаву и превратись потом в беспощадного анархиста. И эта стратегия позволяет организму продержаться до тех пор, пока большинство клеток в ткани не окажутся в ловушке, а оставшиеся не поднимут бунт.
На первый взгляд может показаться, что рак и старость воюют на одной стороне – против долгой жизни человека. На деле же они конкурируют друг с другом, тем самым изрядно усложняя нам задачу. Победив рак, мы столкнемся лицом к лицу с проблемой сенесцентных клеток. Избавившись от старения, мы останемся наедине с нерешенной проблемой рака.
Читать дальшеИнтервал:
Закладка:










