Чарльз Эллис - Эпигенетика
- Название:Эпигенетика
- Автор:
- Жанр:
- Издательство:Техносфера
- Год:2010
- Город:Москва
- ISBN:978-5-94836-257-1
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Чарльз Эллис - Эпигенетика краткое содержание
Книга ярко и наглядно повествует о новой науке общебиологического значения — эпигенетике, а также об ее отдельных областях. В издании представлено описание разных эпигенетических сигналов и механизмов их реализации, а также собственно феномен, история и концепции эпигенетики, ее отдельные механизмы и пути реализации эпигенетических сигналов в клетке. Авторы различных глав данной книги — ведущие в мире специалисты в области эпигенетики, являющиеся, как правило, и основоположниками ее отдельных областей.
Издание будет полезно широкому кругу читателей, интересующихся коренными проблемами живого мира, сущности жизни и молекулярных механизмов ее проявления.
По формирующейся традиции современной российской научной литературы, оригинальное русскоязычное печатное издание неопрятно переведено, отвратительно вычитано и содержит большое количество ошибок, начиная с обложки. Чарльз Дэвид Эллис указан как С. Д. Эллис.
Эпигенетика - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Применение методов обратной генетики с использованием библиотек RNAi у червя-нематоды С. elegans внесло существенный вклад в наше понимание эпигенетического регулирования в ходе развития многоклеточных. Здесь исследования, в которых тщательно прослеживалась судьба клеток и которые позволили детализировать все пути развития для каждой клетки, позволили высветить тот факт, что системы Polycomb и tritorax, вероятно, возникли одновременно с появлением многоклеточности (см. разделы 12 и 13). В частности, эти механизмы эпигенетического контроля имеют существенное значение для регуляции генов в зародышевом пути (глава 15).
Роль эпигенетики в развитии млекопитающих в основном была выяснена на мышах, хотя ряд исследований был распространен на разнообразные линии клеток человека и первичные клеточные культуры. Технологии нокаута и направленных вставок («knock-out» и «knock-in») оказались мощным инструментом для функционального расчленения ключевых эпигенетических регуляторов. Например, мыши, мутантные по метилтрансферазе ДНК, Dnmt1, позволили выяснить функциональную роль метилирования ДНК у млекопитающих (Li et al., 1992). Эта мутация является эмбриональной леталью и демонстрирует нарушение импринтинга (глава 18). Было также показано, что нарушение метилирования ДНК вызывает нестабильность генома и возобновление активности транспозонов, в частности в зародышевых клетках (Walsh et al., 1998; Bourc’his and Bestor, 2004). Охарактеризовано приблизительно 100 факторов, регулирующих хроматин (т. е. ферменты, модифицирующие гистоны и ДНК, компоненты комплексов ремоделинга нуклеосом и механизма РНКи), которые повреждены у этих мышей. Мутантные фенотипы затрагивают пролиферацию клеток, коммитирование клеточных линий, пластичность стволовых клеток, стабильность генома, репарацию ДНК и процессы сегрегации хромосом, как в соматических клетках, так и в зародышевом пути. Неудивительно, что большинство этих мутаций связаны также с развитием заболеваний и рака. Таким образом, многие из этих ключевых успехов в изучении эпигенетического контроля были достигнуты с использованием тех преимуществ, которые обеспечивались уникальными биологическими особенностями, свойственными многим, если не всем, вышеупомянутым модельным организмам. Без этих биологических процессов и их тщательного функционального анализа (генетического и биохимического) многие из недавних успехов в области эпигенетического контроля оставались бы труднодостижимыми.
3. Определение эпигенетики
Из вышеприведенного обсуждения вытекает один острый вопрос: какова та обшая нить, которая связывает разнообразные эукариотические организмы с фундаментальными эпигенетическими принципами? Различные эпигенетические явления объединены, главным образом, тем обстоятельством, что у всех организмов, обладающих настоящим ядром (эукариоты), ДНК не является «голой». Напротив, эта ДНК существует в виде тесного комплекса со специализированными белками, и вместе они составляют хроматин. В своей простейшей форме хроматин — т. е. ДНК, накрученная вокруг нуклеосомных единиц, состоящих из небольших гистоновых белков (Kornberg, 1974), — первоначально рассматривался как пассивная упаковочная структура, служащая для сворачивания и организации ДНК. Однако с помощью разнообразных ковалентных и нековалентных механизмов, выявляемых в настоящее время с большой быстротой, возникают разные формы хроматина (см. раздел 6). В число этих механизмов входит множество посттрансляпионных модификаций гистонов, энергозависимые процессы ремоделинга хроматина, мобилизующие или изменяющие структуру нуклеосом, динамические вставка новых гистонов (вариантов) в нуклеосомы и выход из них, а также направляющая роль малых некодирующих РНК. Сама ДНК у многих высших эукариот также может ковалентно модифицироваться путем метилирования цитозиновых остатков (обычно, но не всегда в динуклеотидах CpG). В совокупности эти механизмы создают набор взаимосвязанных метаболических путей, которые все вместе порождают вариации в полимере хроматина (рис. 3.3).
Многие, хотя и не все из этих модификаций и изменений хроматина, являются обратимыми и, следовательно, вряд ли воспроизводятся в зародышевом пути. Временные метки привлекательны потому, что они вызывают изменения в хроматиновой матрице в ответ на внутренние и внешние стимулы (Jaenisch and Bird. 2003) и тем самым регулируют доступность для транскрипционной машины и (или) возможность ее работы, необходимые для того, чтобы «прочесть» лежащую в основе хроматина матрицу ДНК (Sims et al., 2004; Глава 10). Некоторые модификации гистонов (такие как метилирование лизинов), участки метилированной ДНК и измененные нуклеосомные структуры могут, тем не менее, оставаться стабильными на протяжении нескольких клеточных делений. Благодаря этому возникают «эпигенетические состояния», обеспечивающие клеточную память, которые до сих пор остаются недооцененными и малопонятными. С этой точки зрения, «сигнатуры» хроматина могут рассматриваться как высокоорганизованные системы хранения информации, которые могут индексировать отдельные участки генома и обеспечивать ответ на сигналы, поступающие из внешней среды и диктующие программы экспрессии генов.
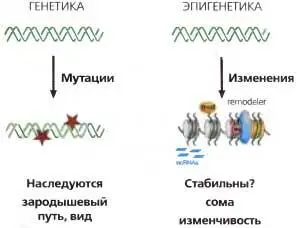
Рис. 3.3.Генетика vs. эпигенетика
ГЕНЕТИКА : мутации ( красные звездочки ) в матрице ДНК ( зеленая спираль ) наследуются соматически и через зародышевый путь. ЭПИГЕНЕТИКА : изменения в структуре хроматина модулируют использование генома с помощью (1) модификаций гистонов (mod), (2) ремоделинга хроматина ( remodeler ). (3) вариантного состава гистонов ( желтая нуклеосома ), (4) метилирования ДНК ( Me ) и (5) некодирующих РНК. Метки на хроматиновой матрице могут наследоваться при клеточных делениях и в совокупности вносят вклад в детерминацию клеточного фенотипа
Значение хроматиновой матрицы, способной реализовать генетическую информацию, заключается в том, что она обеспечивает многомерность уровней считывания информации с ДНК. Возможно, это действительно необходимо, учитывая огромные размеры и сложность эукариотического генома, особенно у многоклеточных организмов (см. детали в разделе 11). У таких организмов оплодотворенное яйцо претерпевает развитие, начиная с единичного генома, который становится эпигенетически запрограммированным на образование множества различных «эпигеномов» в более чем 200 разных типов клеток (рис. 3.4). Было высказано предположение, что эта запрограммированная изменчивость составляет некий «эпигенетический код», существенно расширяющий информационный потенциал генетического кода (Strahl and Allis, 2000; Turner, 2000; Jenuwein and Allis, 2001). Несмотря на всю привлекательность этой гипотезы, мы подчеркиваем, что для ее проверки и проверки других соблазнительных теорий требуется еще поработать. Выдвигаются и альтернативные точки зрения, согласно которым в гистонах чисто комбинаторные «коды», подобные триплетному генетическому коду, мало вероятны или, во всяком случае, далеко еще не установлены (Schreiber and Bernstein, 2002; Henikoff, 2005). Несмотря на такую неопределенность, мы склоняемся к общему мнению, что комбинация ковалентных и нековалентных механизмов действует таким образом, что создаются состояния хроматина, которые могут матрицироваться [be templated] при клеточных делениях и в процессе развития с помощью механизмов, которые только еще начинают выясняться. Вопрос о том, каким именно образом эти измененные состояния хроматина надежно воспроизводятся при репликации ДНК и в митозе, остается одной из фундаментальных проблем для будущих исследований.
Читать дальшеИнтервал:
Закладка: