Михаил Ермолаев - Биологическая химия
- Название:Биологическая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1974
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Ермолаев - Биологическая химия краткое содержание
В учебнике нашли отражение последние научные данные о ферментах, белках, гормонах, обмене веществ и энергии и т. д. Особое внимание обращено на значение и использование данных биохимии в медицине, в связи с чем расширены разделы, посвященные патологии разных видов обменов и их исследованиям в клинике Включены материалы по наследственным заболеваниям, связанным с нарушением синтеза белка и ферментов.
Учебник написан по программе, утвержденной Министерством здраво" хранения СССР, и предназначен для учащихся фельдшерско-лаборантских отделениях медицинских училищ.
Биологическая химия - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
На втором этапе (2 2) произойдет образование конечного продукта исходной реакции и катализатор выделится в неизмененном виде:
АК + В → АВ + К(3)
В этой реакции, энергетический барьер которой обозначим как F 2, F 22<���а.
Суммируя 2-ю и 3-ю реакции, получим:
А + В + К → АВ + К(4)
Таким образом, в ходе реакции с катализатором образовались те же продукты, что и в исходной реакции (1), но с энергетической точки зрения эта реакция более выгодна, так как F 1 + F 2 . Особенно это заметно по энергии активации (а 1 + а 2 <���а) . Следовательно, катализируемая реакция, хотя и идет в 2 этапа, но при этом требуется меньше энергии и значительно снижается энергия активации по сравнению с некатализируемой реакцией.
Катализаторы являются очень активными соединениями, и химические реакции при их участии идут очень быстро, в основном за счет снижения энергии активации. Так, если, например, скорость разложения Н 2О 2без катализатора принять за единицу, то в присутствии катализатора — платиновой черни (неорганический катализатор) скорость реакции увеличивается в 2*10 4раза, а энергия активации снижается соответственно с 18 ккал/ мольдо 12 ккал/ моль. Таким образом, оказывается, что катализатор не только снижает энергетические затраты на течение реакций, но и значительно повышает их скорость.
К основным характеристикам катализа относятся следующие:
• катализаторы могут ускорять (положительный катализ) только те химические реакции, которые вообще могут идти по своим термодинамическим законам,
• катализаторы не изменяют направление хода химической реакции, а только ускоряют достижение состояния равновесия.
Отличие ферментов от других видов катализаторов
При изучении свойств ферментов было установлено, что по своему действию они являются катализаторами, в основном обеспечивающими положительный катализ. Поэтому для них характерны все особенности процесса катализа.
Наряду с этим ферменты имеют свои определенные отличия, к которым относятся "космические" скорости катализируемых ими реакций, очень сложная химическая структура, которая в ряде случаев может изменяться в ходе реакции и восстанавливаться в исходную после ее окончания, и, наконец, высокая специфичность действия.
Для подтверждения высокой скорости реакций, катализируемых ферментами, снова обратимся к нашему примеру с перекисью водорода. В организме разложение Н 2О 2катализируется ферментом каталазой со скоростью, в 2*10 11раз превышающей скорость некатализируемой реакции и в 10 7раз в случае с платиновой чернью. Энергия активации при ферментативной реакции снижается соответственно в 9 и 6 раз. Из других примеров можно указать на следующие. В желудке человека вырабатывается фермент пепсин, который расщепляет белки. Один грамм пепсина за час способен гидролизовать 50 кг яичного белка, а 1,6 г амилазы, синтезируемой в поджелудочной и слюнных железах, за час может расщепить 175 кг крахмала.
Сложность структуры ферментов обусловлена тем, что все они являются белками (см. Структура белков ), т. е. высокомолекулярными соединениями с большим молекулярным весом.
Высокая специфичность действия ферментов проявляется в том, что, как правило, каждый фермент катализирует только одну или несколько близких химических реакций.
Действие ферментов как биологических катализаторов можно изобразить следующей формулой:
S + E  ES → Е + Р,
ES → Е + Р,
где Е — фермент; S — субстрат — вещество, на которое действует фермент; ES — фермент-субстратный комплекс, промежуточное соединение, образующееся в ходе реакции типа АК (2); Р — продукты реакции.
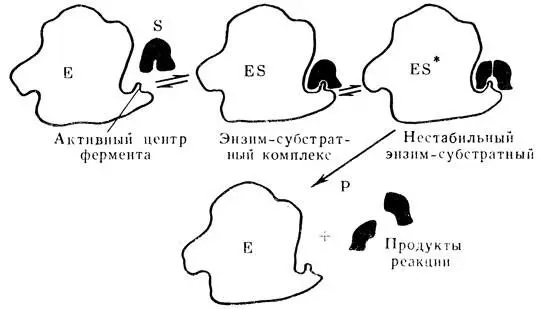
Рис. 38. Схема взаимодействия фермента с субстратом (объяснение в тексте)
И в этом случае действие фермента на субстрат приводит к активированию субстрата, в результате чего снижается энергия активации и повышается скорость реакции. Основное значение в этом имеет образование промежуточного продукта — фермент-субстратного комплекса — ES, скорость образования которого определяет скорость всей реакции. Фермент-субстратный комплекс распадается на фермент и продукты реакции. На рис. 38 дано схематичное изображение хода ферментативной реакции.
Химическая природа ферментов
При изучении ферментов было установлено, что все они являются белками и поэтому обладают всеми свойствами белков. Ферменты имеют аналогичную белкам сложную структуру (рис. 39), подвергаются расщеплению под действием протеолитических ферментов, при растворении в воде образуют коллоидные растворы, при кипячении денатурируются и т. д. Молекулярный вес ферментов колеблется в пределах сотен тысяч и миллионов единиц молекулярного веса.
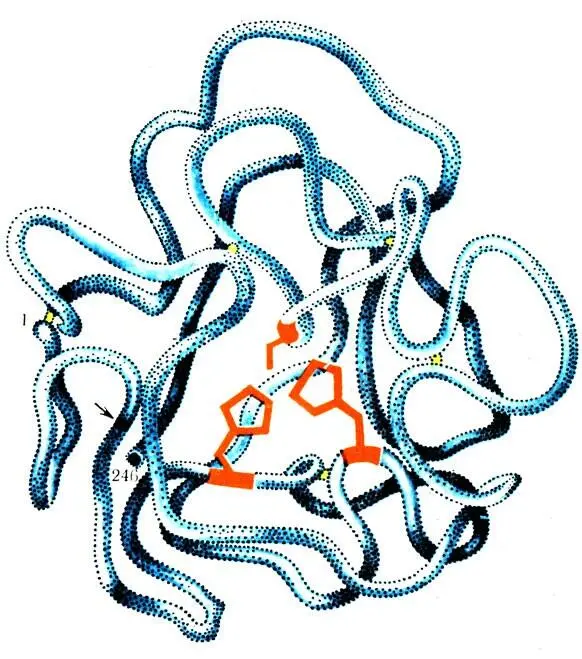
Рис. 39. Гипотетическая модель третичной структуры молекулы химотрипсиногена (по Нейрату). Черное кольцо (обозначено стрелкой) показывает пептидную связь между 15 и 16 аминокислотными остатками. Видны 5 дисульфидных связей (изображены желтым цветом), стягивающим отдельные участки полипептидной цепи% функциональные группы активного центра показаны красным цветом
Молекулярный вес рибонуклеазы составляет 12 700, пепсина — 35 500, каталазы крови — 248 000, глютаматдегидро-геназы — 1 000 000.
По структуре все ферменты делятся на простые и сложные.
Простые ферменты — ферменты-протеины— состоят только из аминокислот, а сложные ферменты — ферменты-протеиды— в своем составе имеют белковую часть — апофермент, состоящую из одних аминокислот, и небелковую часть — кофермент, или простетическую группу. Небелковая часть может быть представлена минеральными веществами, витаминами и т. д.
К ферментам-протеинам относятся, например, гидролитические ферменты желудочно-кишечного тракта, которые расщепляют пищевые продукты с участием воды, к ферментам-протеидам принадлежит большая часть окислительно-восстановительных ферментов.
Методы выделения и количественного определения активности ферментов
Для изучения свойств и клинического применения ферментов необходимы высокоочищенные препараты ферментов. Поэтому были разработаны различные методы выделения ферментов. К ним относятся разрушение клеток и получение клеточного сока, в котором содержатся ферменты; экстрагирование ферментов из высушенных тканей слабыми растворами солей, кислот и оснований. Из растворов ферменты можно осаждать добавлением солей [(NH 4) 2SО 4, NaCl] и различных органических растворителей типа ацетона, смеси спирта и эфира и др.
Читать дальшеИнтервал:
Закладка:









