Михаил Ермолаев - Биологическая химия
- Название:Биологическая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1974
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Ермолаев - Биологическая химия краткое содержание
В учебнике нашли отражение последние научные данные о ферментах, белках, гормонах, обмене веществ и энергии и т. д. Особое внимание обращено на значение и использование данных биохимии в медицине, в связи с чем расширены разделы, посвященные патологии разных видов обменов и их исследованиям в клинике Включены материалы по наследственным заболеваниям, связанным с нарушением синтеза белка и ферментов.
Учебник написан по программе, утвержденной Министерством здраво" хранения СССР, и предназначен для учащихся фельдшерско-лаборантских отделениях медицинских училищ.
Биологическая химия - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Ферменты обладают высокой каталитической активностью, которая зависит от ряда факторов. К ним относятся температура, рН среды, концентрации фермента и субстрата, наличие веществ, активирующих и тормозящих их действие, и т. д.
Зависимость активности фермента и, следовательно, скорости реакции от температуры и рН среды отмечена ранее (см. Свойства ферментов ).
Между концентрацией фермента и скоростью катализируемой реакции при прочих равных условиях имеется прямая пропорциональность. Так, например, при увеличении в 2 раза концентрации фермента скорость реакции также возрастет вдвое.
Влияние концентрации субстрата на скорость действия фермента определяется концентрацией образующегося фермент-субстратного комплекса. Максимальная скорость реакции достигается тогда, когда концентрация субстрата будет достаточна, чтобы связать все количество фермента в фермент-субстратный комплекс.
Активаторы и ингибиторы ферментов
Каталитическая функция ферментов зависит от влияния различных веществ, одни из которых повышают скорость реакций, и активность ферментов возрастает, а другие — ее затормаживают, т. е. ингибируют.
Первые из них нЖываются активаторамиферментов. Например, ионы хлора активируют амилазу слюны, ионы водорода — пепсин, ионы цинка — карбангидразу. Желчные кислоты являются активаторами для кишечной липазы и т. д. Наряду с процессом активации ферментов существует и процесс самоактивации (аутоактивации). Так, в желудке вырабатывается неактивный фермент пепсиноген. Он является предшественником ( проферментом) пепсина. Активация пепсиногена заключается в том, что уже имеющийся в желудке активный фермент — пепсин действует на пепсиноген и отщепляет от его молекулы полипептид с молекулярным весом 7000. Оставшаяся часть молекулы пепсиногена приобретает определенную форму, характерную для активного фермента — пепсина. Аналогичным путем происходит активирование и некоторых других ферментов (например, трипсина).
Вещества, способные угнетать действие ферментов, называются парализаторами, или ингибиторами (I). Механизм действия ингибиторов в общем виде заключается в том, что ингибитор вступает в соединение с ферментом, образуя неактивный фермент-ингибиторный комплекс (EI) вместо активного фермент-субстратного (ES), что приводит к блокированию фермента. Торможение активности ферментов ингибиторами может быть обратимым и необратимым. В последнем случае ингибитор, являясь денатурирующим агентом, приводит к полному изменению структуры фермента, его инактивации. К таким ингибиторам относятся сильные кислоты и щелочи, спирт, цианистые соли и т. д.
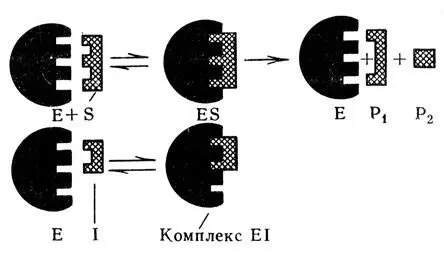
Рис. 40. Схема действия конкурентного ингибитора (объяснение в тексте)
Различают также конкурентное и неконкурентное ингибирование. Конкурентноеторможение возможно в том случае, когда ингибитор имеет структуру, близкую структуре субстрата, т. е. является его структурным аналогом. В основе этого вида торможения лежит конкуренция между субстратом и ингибитором за обладание ферментом. В результате этого ингибитор обратимо взаимодействует с тем участком в молекуле фермента, с которым. обычно соединяется субстрат (рис. 40). Из рисунка видно, что между молекулами фермента и субстрата имеется структурное соответствие, которое обеспечивает образование активного фермент-субстратного комплекса. Последний затем расщепляется с образованием продуктов реакции, а фермент выделяется в неизмененном виде. В случае конкурентного торможения ингибитор (структурный аналог субстрата) присоединяется к ферменту в том же участке, что и субстрат, в результате чего субстрат уже не может соединиться с ферментом. Конкурентное ингибирование обратимо и зависит от концентрации ингибитора и субстрата. Если концентрация ингибитора (I) выше, чем субстрата (S), т. е. [I]>[S], образуется фермент-ингибиторный комплекс Е + S + I → EI + S и расщепления субстрата не произойдет. Но в случае избытка субстрата — [S]>[I], последний вытеснит ингибитор из фермент-ингибиторного комплекса и образуется фермент-субстратный комплекс с последующим распадом субстрата на продукты реакции:
Е + S + I → ES + I → Е + Р + I.
Таким образом, конкурентное торможение — это такое торможение, когда ингибитор обратимо соединяется с ферментом в том участке его молекулы, в котором присоединяется и субстрат (активный центр), причем между субстратом и ингибитором существует количественное взаимоотношение. Классическим примером конкурентного торможения служит конкуренция между янтарной кислотой — субстрат и малоновой- ингибитор за фермент сукцинатдегидрогеназу, которая катализирует образование фумаровой кислоты из янтарной:

При неконкурентном торможенииингибитор соединяется с ферментом не по месту присоединения с субстратом (не с активным центром), а где-то в другом участке молекулы фермента, что приводит, к значительному снижению активности фермента и даже к его ингибированию. Таким примером является действие синильной кислоты на железосодержащие ферменты, осуществляющие перенос электронов при окислительно-восстановительных реакциях.
Общие представления о механизме действия ферментов
Механизм действия ферментов пока изучен недостаточно, однако имеющиеся данные позволяют высказать о нем общее представление.
В основе действия ферментов как биологических катализаторов лежит их способность повышать скорость реакции за счет снижения энергии активации субстрата, т. е. каким-то образом его активировать. Это достигается при взаимодействии субстрата с ферментом, который вызывает какие-либо изменения в молекуле субстрата, в результате чего он становится активным (реакционноспособным). Следовательно, необходимым условием для активации субстратов и понимания механизма действия ферментов является образование фермент-субстратного комплекса. Пути и механизмы, приводящие к активированию субстрата, могут быть самыми различными и зависят от структуры ферментов. В качестве примера можно привести предполагаемый механизм действия фумаразы — фермента-протеина, который вызывает активирование фумаровой кислоты, вследствие чего к ней присоединяется молекула воды и образуется яблочная кислота.
В фумаровой кислоте имеется двойная связь, которая представлена парами электронов. Под действием фумаразы происходит их перераспределение, что приводит к появлению зарядов на молекуле субстрата (субстрат активируется). Последний становится способным присоединять ионы (Н +и ОН -) по типу электростатической связи:
Читать дальшеИнтервал:
Закладка:









