Михаил Ермолаев - Биологическая химия
- Название:Биологическая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1974
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Ермолаев - Биологическая химия краткое содержание
В учебнике нашли отражение последние научные данные о ферментах, белках, гормонах, обмене веществ и энергии и т. д. Особое внимание обращено на значение и использование данных биохимии в медицине, в связи с чем расширены разделы, посвященные патологии разных видов обменов и их исследованиям в клинике Включены материалы по наследственным заболеваниям, связанным с нарушением синтеза белка и ферментов.
Учебник написан по программе, утвержденной Министерством здраво" хранения СССР, и предназначен для учащихся фельдшерско-лаборантских отделениях медицинских училищ.
Биологическая химия - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
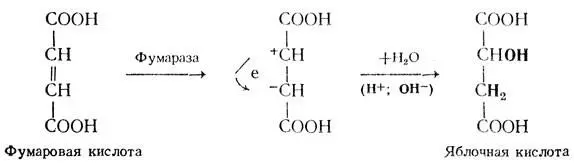
При изучении механизма действия сложных ферментов оказалось, что в процессе активации субстрата принимает участие и небелковая часть — кофермент. Кроме того, было обращено внимание на следующие обстоятельства. Одно из них заключается в том, что молекула фермента во много раз больше молекулы субстрата, и поэтому субстрат не может быть связан со всей молекулой фермента. Второе обстоятельство характеризуется тем, что при отщеплении от молекулы фермента определенного количества аминокислот фермент продолжает катализировать те же самые реакции с высокой скоростью, что и нерасщепленный фермент. Например, при удалении из молекулы папаина (фермента, катализирующего распад белков в растениях) 120 из 180 аминокислот, входящих в состав его молекулы, фермент сохранял свои каталитические способности.
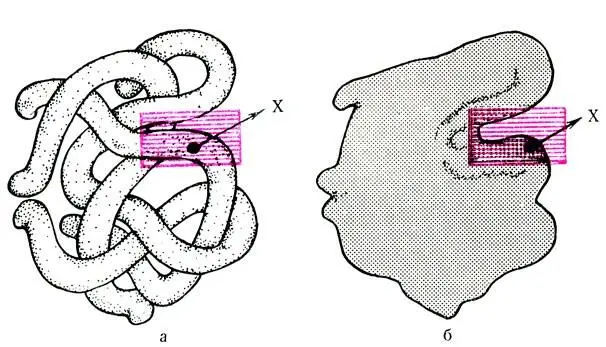
Рис. 41. Модель молекулы фермента. а — схема ее гретичной структуры; б — силуэт молекулы с активным центром (обведен пунктиром) и его 'каталитически активным' центром (х)
Эти факты привели к выводу о том, что фермент взаимодействует с субстратом не всей своей молекулой, а каким-то вполне определенным участком, расположенным на поверхности фермента (на третичной структуре). Этот участок был назван активным центром(рис. 41). В составе активного центра условно выделяют несколько участков, одни из которых обеспечивают присоединение субстрата к молекуле фермента (их называют контактными, или якорными, участками), другие — каталитические — ответственны за процесс активации субстрата. В этих участках имеются различные функциональные группировки, которые находятся в строго зафиксированном положении по отношению друг к другу. Эта особенность строения активного центра объясняет специфичность действия ферментов, так как образование фермент-субстратного комплекса возможно только в случае структурного подобия субстрата и активного центра фермента.
Под действием различных факторов (высокая температура, изменение рН среды, химические вещества) нарушается структура активного центра и фермент теряет способность взаимодействовать с субстратом, т. е. фермент инактивируется.
Классификация ферментов
В 1961 г. в Москве на V Международном биохимическом съезде была принята новая классификация ферментов. В основу деления всех ферментов на различные группы был положен тип катализируемой данным ферментом реакции. По этому принципу все ферменты были разделены на 6 классов:
• I класс — оксидоредуктазы. К этому классу относятся все ферменты, которые катализируют окислительно-восстановительные реакции. Примером могут служить дегидрогеназы — ферменты, переносящие атомы водорода.
• II класс — трансферазы. Ферменты этого класса осуществляют межмолекулярный перенос отдельных функциональных групп. Например: метальные группы -СН 3— переносят метилтрансферазы, аминные — NH 2— аминотрансферазы и т. д.
• III класс — гидролазы. Ферменты этого класса гидролизуют внутримолекулярные связи с участием воды. Сюда относится большая группа ферментов, в том числе почти все ферменты желудочно-кишечного тракта: эстеразы, фосфатазы, пептидазы и др.
• IV класс — лиазы. В основу выделения ферментов в этот класс положена их способность расщеплять не гидролитическим путем соединения с двойными связями. К ним относятся декарбоксилазы, ферменты, отщепляющие от субстратов СО, и др.
• V класс — изомеразы. Эти ферменты катализируют взаимопревращение субстратов. Например: L-изомеры превращаются в D-формы, глюкоза — во фруктозу и т. д.
• VI класс — лигазы, или синтетазы. Ферменты этого класса участвуют во всех реакциях синтеза различных соединений.
Каждый класс в свою очередь подразделяется на подклассы, а последние на подподклассы, в которых расположены индивидуальные ферменты. Поэтому каждый фермент зашифрован четырьмя цифрами, каждая из которых обозначает номера класса, подкласса, подподкласса и индивидуальный номер фермента.
Новая классификация ферментов позволяет быстро найти нужный фермент и определить его действие.
На этом же съезде была предложена новая номенклатура ферментов. Каждый фермент имеет название, в котором отражены тип катализируемой ферментом реакции, название субстрата, на который действует фермент и окончание — аза. Например, в клетках печени имеется фермент, который расщепляет глюкозо-6-фосфат на глюкозу и фосфорную кислоту по схеме: глюкозо-6-фосфат + Н 2О — глюкоза + Н 3РО 4.
Фермент, катализирующий эту реакцию, называется глюкозо-6-фосфат-фосфо-гидролаза. В названии указан тип катализируемой реакции — гидролиз, субстрат, на который действует фермент — глюкозо-6-фосфат, и, наконец, окончание аза. Наряду с новой номенклатурой ферментов ряд ферментов сохранил свои старые названия, которые прочно вошли в практику: пепсин, трипсин и др.
Значение ферментов для медицины
Жизнедеятельность любого организма обусловлена постоянным и строго последовательным течением тысяч химических реакций, катализируемых ферментами.. Поэтому любые нарушения нормальных функции организма в основе своей имеют расстройство обменных процессом, нарушение деятельности ферментов (ферментопатии). С этих позиций большинство заболеваний можно характеризовать с точки зрения изменений деятельности ферментов. Механизм возникновения подобных отклонений, роль ферментов в патологии и этиологии заболеваний, в диагностике и лечении нее эти вопросы входят в самостоятельный раздел биохимии — медицинскую ферментологию.
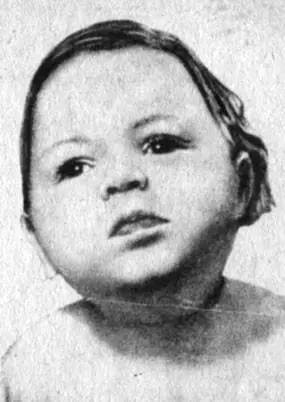
Рис. 42. Фенилпировиноградная олигофрения у мальчика в возрасте 15 месяцев (по Майстер)
При изучении заболеваний было установлено, что первопричиной ряда из них являются нарушения синтеза ферментов. К ним относятся наследственные заболевания, такие, как фенилпировиноградная олигофрения, галактоземия, различные виды гемолитических анемий, гликогенозы, разнообразные формы нарушения свертывания крови и т. д. Например, механизм развития фенилпировиноградной олигофрении (слабоумие) заключается в том, что у больных детей нарушен синтез фенилаланин-гидроксилазы — фермента, который обеспечивает синтез тирозина из фенилаланина. Следствием является накопление в организме высоких концентраций фенилаланина и продуктов его нарушенного обмена, оказывающее губительное действие на развитие организма, в том числе мозга. У такого ребенка наряду с отставанием роста развивается психическая неполноценность (рис. 42).
Читать дальшеИнтервал:
Закладка:









