Михаил Супотницкий - Биологическая война (Часть 3)
- Название:Биологическая война (Часть 3)
- Автор:
- Жанр:
- Издательство:Кафедра, Русская панорама
- Год:2013
- Город:Москва
- ISBN:978-5-93165-328-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Супотницкий - Биологическая война (Часть 3) краткое содержание
Часть 3. Частная неправильная эпидемиология.
Биологическая война (Часть 3) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
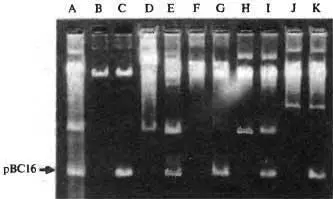
Рис 3.8. Переданная посредством фаговой трансдукции чужеродная плазмида у В. anthracis и в других бациллах, Широкая диффузная полоса соответствует фрагментам хромосомной ДНК. А. В. cereus GР7. В. В. anthracis Weybiidge A UM18. С. В. armtraas Weybridge A UM18(pBC16), D. В. thuringiensis 40428 UM45 Е. В. thuringiensis 40428 UM45(pBC16). F. В. thuringiensis 406 °C UM473. G. В. thuringiensis 406UC UM473(pECl6). H. B. thuringiensis YGA UM1.1. B. thuringiensis YGA UMl(pBC16). J. B. cereus 5°9 UM47. К. B. cereus 569 UM47(pBC16). Перенос плазмиды pBC16 (2,b мДа, Тс r) осуществлен бактериофагом СР-51. Фенотипически наличие у реципиентного штамма плазмиды рВC16 проявляется устойчивостью к тетрациклину/ По R. Е. Ruhfel et al. (1984)
На электрофореграммах ДНК разделенной в агарозном геле (см. рис. 2.3 и 3.8), «лишняя» плазмида обнаруживается в виде фракции, дополнительной к собственным плазмидам (для рВС16 — фракция, по подвижности соответствующая ММ 2,8 мДа). Далее «лишнюю» плазмиду можно выделить из агарозного геля (вырезав соответствующий кусочек из геля), перетрансформировать в более удобную для генетических исследований бациллу, чем В. anthracis [4] В основном эти неудобства были связаны с гомологичной рекомбинацией и действием рестриктирующих ферментов бацилл, при водящих к нестабильности чужеродных плазмид. Поэтому такие эксперименты тогда старались выполнять, используя в качестве реципиента мутантные В. subtilis с отключенными системами рекомбинации и рестрикции (штаммы MI 112, МI119, МI120 и др.).
, получить в препаративных количествах и установить ее происхождение путем молекулярного сравнения с известными плазмидами, имеющими то же предназначение.
Появившиеся в начале 1990-х гг. интегративные векторы позволяют вставить чужеродный ген непосредственно в хромосому бактерии (см. разд. 2.2.2 «Технологии рекомбинантной ДНК в получении штаммов бактерий с неправильной эпидемиологией»). Пример получения штаммов сибиреязвенного микроба с интегрировавшимися в их хромосому генами сфингомиелиназы и фосфолипазы приводят Л. И. Маринин с соавт. (1999). По их данным, В. anthracis Ч-7(рОВ12) вызывал сибиреязвенную инфекцию у лабораторных животных, иммунизированных вакциной на основе штамма СТИ-1. Однако ни методы электрофоретического разделения ДНК, ни хорошо зарекомендовавшие себя для обнаружения инфекционных агентов диагностические тесты, основанные на амплификации ДНК (ПЦР в любых вариантах исполнения), не могут быть использованы для обнаружения генетически модифицированных патогенов, если новая генетическая информация «добавлена» в их хромосому. Основной недостаток таких способов состоит в том, что они требуют предварительного и досконального знания специфических генетических вариантов микроорганизма, изучаемого на предмет генетической модификации. В последние годы эту задачу пытаются решить на принципиально более высоком уровне — используя новые платформы секвенирования и, в частности, пиросеквенирование. Способ позволяет установить разнообразные типы генетических изменений в геноме — инсерции и делеции, единичные нуклеотидные полиморфизмы, единичные тандемные повторы и вариабельные участки генов, Chen P. Е. et al. (2010) исследовали возможности способа для выявления генетически измененных штаммов В. anthracis Ames Ancestor [5] В экспериментах используется штамм Ames с искусственной устойчивостью к ципрофлоксацину. Его природный вариант обладает резистентностью к пенициллинам третьего поколения и способностью преодолевать иммунитет, создаваемый коммерческими сибиреязвенными вакцинами. Это его «террористы» применили в США для совершения так называемой «почтовой атаки» осени 2001 г., сыгравшей главную роль в нагнетании в мире обстановки страха перед якобы возрастающей угрозой биотерроризма со стороны Саддама Хусейна (см. разд. 1.12.4). Тогда ципрофлоксацин помог избежать массовой гибели американских граждан от сибирской язвы (см. далее «Клинические примеры искусственно вызванной сибирской язвы»).
и Sterne. В частности, по результатам пиросеквенирования ими в геноме штаммов сибиреязвенного микроба выявлены вставки генной кассеты с геном резистентности к эритромицину; мутации, предопределяющие низкоуровневую и высокоуровневую резистентность В. anthracis к ципрофлоксацину; идентифицированы мутации, приводящие к спонтанной резистентности к фагу и др. изменения. Эти исследования поставили некую планку, ниже которой в ближайшем десятилетии исследования по идентификации генетически измененных агентов ВО опускаться не будут.
Патогенез.В клинике сибирской язвы преобладают две группы симптомов:
1) обусловленные способностью В. anthracis к генерализации в клетках лимфоидной системы с последующим развитием септической формы болезни.
2) проявления местного патологического процесса, обусловленного действием экзотоксина В. anthracis (повышение проницаемости капилляров, нарушения микроциркуляции, отек тканей и коагуляционный некроз) в первичном фокусе инфекции;
На месте внедрения возбудителя в кожу развивается сибиреязвенный карбункул (реже — эдематозная, буллезная и эризипелоидная формы поражения кожи) в виде очага серозно-геморрагического воспаления с некрозом, отеком прилегающих тканей, регионарным лимфаденитом. Развитие лимфаденита обусловлено заносом возбудителя подвижными макрофагами из места внедрения в ближайшие регионарные лимфатические узлы. Дальнейшая генерализация В. anthracis с прорывом ее в кровь и развитием септической формы болезни происходит при кожной форме че-резвычайно редко Сибиреязвенный сепсис обычно развивается при внедрении возбудителя в организм человека через слизистые поверхности дыхательнь х путей или желудочно-кишечного тракта. Инфицировав макрофаги, споры быстро достигают эн-посомальных компартментов, где должно происходить их разрушение. Однако некоторые споры остаются жизнеспособными и после прорастания превращаются в бациллы, которые реплицируются внутри макрофагов. В этих случаях нарушение барьерной функции трахеобронхиальных (бронхопульмональных) или мезентериальных лимфатических узлов приводит к генерализации процесса. Бактериемия и токсинемия вызывают развитие инфекционно-токсического шока. В случаях развития легочной формы болезни, перибронхиальные геморрагические лимфадениты блокируют легочный лимфатический дренаж, вызывая отек легких (Dixon D. et al., 1999; Шувалова Е. П. с соавт., 2001).
Размножению В. anthracis в макрофагах способствует летальный фактор сибиреязвенного токсина. Подвергнутые его воздействию макрофаги не утрачивают способности поглощать споры возбудителя сибирской язвы, однако в значительной мере теряют способность освобождаться от них (Ribot W. et al., 2006). Патогенез сибиреязвенной инфекции у млекопитающих показан на рис. 3.9.
Читать дальшеИнтервал:
Закладка:







![Михаил Супотницкий - Очерки истории чумы. Книга II. Чума бактериологического периода [без иллюстраций]](/books/1084186/mihail-supotnickij-ocherki-istorii-chumy-kniga-ii.webp)
![Михаил Супотницкий - Очерки истории чумы. Книга I. Чума добактериологического периода [без иллюстраций]](/books/1084187/mihail-supotnickij-ocherki-istorii-chumy-kniga-i-ch.webp)

