Андрей Брюховецкий - Боковой амиотрофический склероз
- Название:Боковой амиотрофический склероз
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:9785005300577
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Андрей Брюховецкий - Боковой амиотрофический склероз краткое содержание
Боковой амиотрофический склероз - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
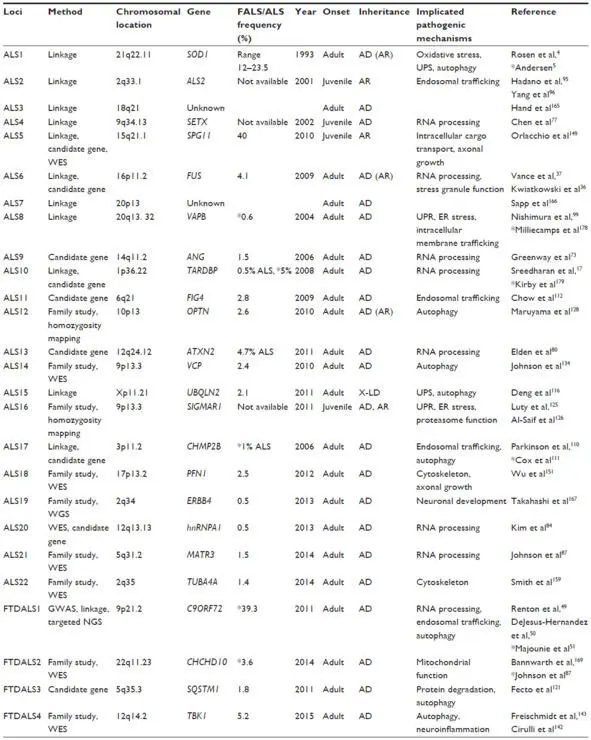
Примечание. Нумерация локусов ALS и FTDALS определяется онлайн-каталогом фенотипических маркеров у человека OMIM®. Частота мутаций в FALS основана на данных из исходных статей или ссылок, помеченных звездочкой (*). В некоторых случаях предоставляется частота в ALS, а не FALS (цит. по: Al Sultan et al., 2016 ).
Совсем недавно было показано, что мутантный SOD1 (mtSOD1), вместе с неправильно свернутым SOD1 дикого типа, продвигаются от клетки к клетке и инициируют прионо-подобное скопление SOD1 (Grad et al., 2014; Munch, Bertolotti, 2011). Тогда как первоначальное исследование продемонстрировало разрастание неправильно свернутого белка в моделях клеточных культур, спинальные гомогенаты, изъятые из парализованного мышиного мутанта G93A SOD1 и пересаженные в 6-месячную G85R-SOD1:YFP мышиную модель (в которой обычно болезнь не развивалась раньше, чем до 20 мес.), вызывали прогрессирующую болезнь двигательного нейрона в течение 3 месяцев (Ayers et al., 2016).
В обычном виде неправильно свернутые белки изымаются из клеток через механизм действия системы убиквитин-протеасомы (UPS). Однако в БАСе, обусловленном геном SOD1, а также в спорадическом БАСе было показано, что действие системы убиквитин-протеосомы (UPS) нарушается (Kabashi et al., 2012, Kabashi, Durham, 2006). Кроме того, было показано, что MGRN1 (mahogunin ring finger 1), являющийся E3 убиквитин-лигазой, которая катализирует и ускоряет моноубиквитинирование белков и помечает их для деградации при помощи UPS-независимого механизма, сокращается в G93A мышиной модели. Любопытно, однако, что сверхэкспрессия этого белка приводила к сокращению SOD1-токсичности за счет подавления агрегации (скопления) SOD1. Таким образом, терапевтические стратегии по лечению БАС включают повышение очищения от неправильно свернутого SOD1, и индуктор белка теплового шока, arimoclomol, представляет собой один из подобных препаратов, разрабатываемых и изучаемых в настоящее время (Kalmar et al., 2014).
Хотя вначале окислительный стресс считался одним из основных механизмов мутантных SOD1, продолжающиеся исследования патогенного действия SOD1 привлекли и такие факторы, как система убиквитин-протеасомы (UPS), накопление и деградация белков, а также другие аспекты белкового трафика. Подобные пути также связаны с открытием дополнительных генов семейных БАС (FALS) (Раздел «Белковый трафик и гены, имеющие отношение к деградации»).
ALS10/БАС10: TAR ДНК-соединительный белок (TARDBP)
Транзактивный ДНК-связывающий белок 43 (TDP-43) кодируется геном TARDBP на chr1p36.22 (Sreedharan et al., 2008). Ген TARDBP ответственен за 4—5% семейных БАС и примерно 1% спорадических случаев БАС (Millecamps et al., 2010). Мутации в TARDBP наследуются в виде аутосомно-доминантных (AD) проявлений и ассоциируются с классическим клиническим фенотипом БАС. Ген TARDBP кодирует несколько изоформ, из которых преобладает TDP-43. Изоформа TDP-43 является гетерогенным ядерным рибонуклеопротеином (hnRNP), наделенным сигналом ядерной локализации (NLS) и сигналом ядерного экспорта, что способствует челночному перемещению белка между ядром и цитоплазмой. В белке TDP-43 содержатся три последующих домена, два мотива распознавания РНК (RRM1 and RRM2), которые участвуют в соединении РНК и ДНК, а также глицин-обогащенный домен, который необходим для взаимодействия с другими белками и представляет собой локализацию, в которой происходит большинство мутаций (Baralle et al., 2013; Lagier-Tourenne et al., 2010).
Первоначально TDP-43 был идентифицирован как транскрипционный репрессор, соединяющийся с TAR ДНК в вирусе-1 иммунодефицита человека (Ling et al., 2015). После этого было продемонстрировано, что TDP-43 играет роль в РНК-метаболизме, в том числе в РНК-транскрипции, альтернативном сплайсинге, предварительном микроРНК-процессинге, РНК-транспорте и устойчивости матричной РНК (messenger RNA, mRNA) (Scotter et al., 2015). Белок TDP-43 обладает способностью самостоятельно регулировать экспрессию собственных генов за счет соединения с 3́нетранслируемой областью (3́UTR) своего матричного РНК, что порождает неустойчивость и разложение (Ayala et al., 2015). Также TDP-43 соединяется с UG-обогащенными последовательностями в многочисленных последовательностях mRNA (матричной РНК) в целях регулирования сплайсинга (Polymenidou et al., 2011; Sephton et al., 2011; Xiao et al., 2011). Кроме того, недавно была обнаружена новая функция, при которой TDP-43 может подавлять сплайсинг несохраненных (неконсервированных) экзонов, известных как криптические экзоны (Ling et al., 2015). Устранение TDP-43 позволяло этим криптическим экзонам встраиваться в последовательности mRNA (матричной РНК), что затем прерывало транслирование и вызывало нонсенс-опосредованное разрушение. Наконец, TDP-43 также известен в качестве составляющего компонента стрессовых гранул (SGs), хотя и неясно, способствует ли это обстоятельство процессу нейродегенерации (Aulas, Vande Velde, 2015). Роль белка TDP-43 весьма заметна в характерных убиквитиновых цитоплазматических включениях, которые обнаруживаются у больных с БАС и лобно-височной деменцией (Neumann et al., 2006). Примерно 97% больных с семейной и спорадической формами БАС являются положительными для TDP-43 включений в двигательном кортексе и спинном мозге, тем самым подчеркивается значение TDP-43 как основной белковой сигнатуры заболевания, а не только тех белков, переносящих TARDBP-мутации (Sreedharan et al., 2008; Qin et al., 2014).
Потеря ядерной локализации TDP-43 при БАСе хорошо задокументирована, и существуют данные о наступающем в результате этого дефиците сплайсинга в клеточных и животных моделях БАС, а также в образцах, взятых у пациентов (Ling et al., 2015; Highley et al., 2014; De Conti et al., 2015). Кроме утраты ядерной функции, цитоплазматическое приобретение функции также может способствовать нейродегенерации. Модель мыши с мутацией в сигнале ядерной локализации TARDBP человека, что ограничивало TDP-43 до уровня цитоплазмы, продемонстрировала увеличенную экспрессию связанных с транскрипцией и хроматиновой сборкой генов и генов обработки гестона 3́UTR (Amlie-Wolf et al., 2015). Важно отметить, что подобные транскрипционные изменения не наблюдались при добавлении антисмыслового олигомера к нокдаун TDP-43 экспрессии, что, таким образом, поддерживало идею о цитоплазматическом токсическом приобретении функции. Наконец, как и в случае прионоподобного распространения заболевания, описанного при SOD-БАСе, были также получены доказательства того, что TDP-43 олигомеры дикого типа могут распространяться горизонтально от клетки к клетке через микровезикулы, в том числе через лизаты головного мозга больных БАС, а также вертикально по аксонам (Feiler et al., 2015). Таким образом, снижение скоплений подобных мутантных протеинов постепенно становится все более широко используемой терапевтической стратегией.
Читать дальшеИнтервал:
Закладка:









