Борис Степин - Книга по химии для домашнего чтения
- Название:Книга по химии для домашнего чтения
- Автор:
- Жанр:
- Издательство:Химия
- Год:1994
- Город:М.
- ISBN:5-7245-0708-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Борис Степин - Книга по химии для домашнего чтения краткое содержание
В виде небольших рассказов, заметок и ответов на вопросы приведены сведения из различных разделов химии и эпизоды из жизни ученых-химиков. Цель книги — дать читателю представление о химии как о необходимом звене, гармонично связывающем нас с природой, позволяющем создавать необходимые цивилизованному миру предметы и материалы.
Книга рассчитана на широкий круг читателей — преподавателей и студентов, школьников и пенсионеров, инженеров и домохозяек. Любознакльные найдут здесь интересные факты, а практичные читатели — полезные советы и рекомендации.
Книга по химии для домашнего чтения - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
3.31. ОТЧЕГО УКУСЫ МУРАВЬЕВ ТАК БОЛЕЗНЕННЫ? ЕДИМ ЛИ МЫ ЩАВЕЛЕВУЮ КИСЛОТУ!
Муравьиная кислота (или «муравьиный спирт») была открыта в 1794 г. немецким химиком Маргграфом (см. 1.61) в кислых выделениях рыжих муравьев. Она же находится в волосках жгучей крапивы. Современное название этой кислоты — метановая, а ее состав отвечает формуле НСООН. Метановая кислота — это резко пахнущая жидкость, самая сильная из органических кислот, она вызывает сильные ожоги на коже (см. 2.17). Соли ее называют формиатами («формика» по-латыни значит «муравей») или метанатами.
Муравьиную кислоту получают действием разбавленной серной кислоты на формиаты, например на формиат калия:
Муравьиная кислота обладает бактерицидными свойствами; за рубежом ее применяют как консервант при заготовке силоса. Народная медицина традиционно использовала муравьиную кислоту для лечения ревматических болей и радикулитов, при этом источником лекарства служили живые муравьи. Пчеловоды ценят муравьиную кислоту как эффективное средство от варроатоза — болезни пчел, связанной с пчелиными клещами-паразитами.
Щавелевая, или этандионовая, кислота состава H 2C 2O 4∙2Н 2O образует бесцветные кристаллы, хорошо растворимые в воде. Соли щавелевой кислоты называют оксалатами.
Немецкий химик, аптекарь и сенатор Иоганн-Христиан Виглеб (1732–1800) получил из сока щавеля и кислицы неизвестное вещество, водный раствор которого давал осадок с известковой водой (см. 3.23). В 1784 г. Шееле (см. 2.7) установил, что вещество, полученное Виглебом, — кислота, и назвал ее щавелевой. Взаимодействие ее с известковой водой отвечает реакции
Щавелевая кислота чрезвычайно распространена в природе. В виде гидрооксалата калия KHC 2O 4она содержится б щавеле, кислице, а в виде оксалата кальция CaC 2O 4входит в состав почти всех растений. Получают щавелевую кислоту из оксалата кальция обработкой последнего серной кислотой:
3.32. «ДРЕВЕСНАЯ КИСЛОТА». «КРИМИНАЛЬНОЕ» ПРОИСХОЖДЕНИЕ БЕНЗОЛЬНОГО КОЛЬЦА
Знаете ли вы, что слово «уксус» происходит от греческого слова «оксос», означающего «кислый»?
В древности уксус был единственной пищевой кислотой, и неудивительно, что название его отождествлялось с самим представлением о кислом, кислоте. В России уксус, т. е. водный раствор уксусной кислоты CH 3COOH, называли «кислой влажностью» или «древесной кислотой» (см. 1.50). Уксусом как пищевой приправой люди стали пользоваться почти три тысячи лет назад, а со временем в пищу стали добавлять и другие кислые вещества, например лимонную кислоту (см. 3.28). Наверное, древним грекам было бы очень странно слышать наш термин «уксусная кислота» — буквально «кислая кислота»…
Отметим, что все перечисленные выше (см. 3.27–3.32) органические кислоты содержат в своем составе карбоксильную группу — СООН, которая служит источником протонов при взаимодействии этих веществ с водой в растворе; этим и обусловлены их кислотные свойства (см. 3.11).
Знаете ли вы, что кольцевая структура бензола C 6H6 родилась в уме немецкого химика Кекуле (см. 2.35) после судебного процесса по убийству графини Герлиц?
На этом процессе демонстрировалось в качестве улики кольцо в виде двух переплетенных змеек. Юный Кекуле жил в доме напротив особняка графини и поэтому выступал свидетелем по делу. Его точные показания убедили в правильности заключения эксперта Либиха (см. 2.17).
Картина бензольного кольца в виде сплетенных змеек возникла у Кекуле много лет спустя во время размышлений о структуре бензола. Он так описал рождение в его уме бензольного кольца: «Я занимался работой над своим «Учебником»… мои мысли где-то витали… Длинные нити очень часто сближались и свертывались в трубку, напоминая двух змей. Одна из них вцепилась в собственный хвост, продолжая насмешливо кружиться перед моими глазами».
Вот что представляет собой бензольное кольцо:
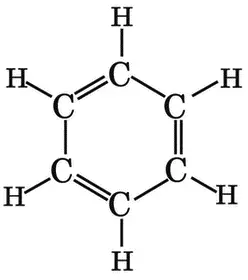
Левая структура бензола C 6H 6и две средних предложены Кекуле. Правая используется в наши дни. Кекуле предположил, что двойные связи = в C 6H 6делокализованы, они перемещаются по кольцу, характеризуя мгновенные состояния молекулы. Позднее эта гипотеза была подтверждена экспериментально, и теперь перемещение двойных связей изображают кружком внутри бензольного кольца, внутри шестиугольника.
3.33. ЧТО ОЗНАЧАЕТ НАЗВАНИЕ «РОДАНИДЫ»?
Название «роданиды» (для солей с анионом NCS -) образовалось от греческого слова «родон» — роза, розовый. Добавление роданидов щелочных металлов, в частности роданида калия KNCS, к водному раствору солей железа(III) (например, трихлорида железа FeCl 3) вызывало пояьление ярко-красного окрашивания раствора из-за образования комплексных частиц состава [Fe(NCS) 6] 3-в результате реакции
Современное название «тиоцианаты» включает два слова: «тио» — сера и «цианат» — ион NCO -, в котором атом кислорода замещен на атом серы (NCS -). Такое название отражает состав иона и является поэтому предпочтительным.
3.34. ЧТО ТАКОЕ «ТЕНАРОВА СИНЬ»?
Тенарова синь — двойной оксид алюминия и кобальта состава (CoAl 2)O 4— тетраоксид диалюминия-кобальта. Не так давно тенарову синь считали алюминатом кобальта и записывали ее состав формулой Co(AlO 2) 2. Вещество это получило свое название по имени французского химика Тенара (см. 1.45), предложившего реакцию образования этого оксида для обнаружения алюминия в минералах. Если, например, оксид алюминия смочить несколькими каплями водного раствора нитрата кобальта Co(NO 3) 2и затем прокалить, то появляется красивая синяя окраска:
3.35. ГЛАУБЕРОВА СОЛЬ
В медицинских руководствах до сего времени встречаются такие названия: «горькая соль», «слабительная соль», «глауберова соль».
«Горькая», «слабительная» или «глауберова» соль — это одно и то же вещество, декагидрат сульфата натрия Na 2SO 4∙10H 2O. Он встречается в природе в больших количествах в виде минерала мирабилита (см. 10.44). Особенно много мирабилита добывается в заливе Кара-Богаз-Гол на Каспийском море. Сульфат натрия был получен впервые Глаубером (см. 8.12) при действии серной кислоты H 2SO 4, которую он назвал «ацидум олеум витриоли», на хлорид натрия (см. 1.52 и 10.51):
Остаток твердого вещества после окончания реакции Глаубер растворил в воде и оставил для кристаллизации Na 2SO 4∙10H 2O, а хлороводород НСl, выделившийся в результате прокаливания, при поглощении водой дал хлороводородную кислоту, которую, кстати, долгое время называли «дымящим соляным спиртом Глаубера» (см. 3.10). Позже ее стали называть соляной кислотой (см. 3.12).
Читать дальшеИнтервал:
Закладка:










