Борис Степин - Книга по химии для домашнего чтения
- Название:Книга по химии для домашнего чтения
- Автор:
- Жанр:
- Издательство:Химия
- Год:1994
- Город:М.
- ISBN:5-7245-0708-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Борис Степин - Книга по химии для домашнего чтения краткое содержание
В виде небольших рассказов, заметок и ответов на вопросы приведены сведения из различных разделов химии и эпизоды из жизни ученых-химиков. Цель книги — дать читателю представление о химии как о необходимом звене, гармонично связывающем нас с природой, позволяющем создавать необходимые цивилизованному миру предметы и материалы.
Книга рассчитана на широкий круг читателей — преподавателей и студентов, школьников и пенсионеров, инженеров и домохозяек. Любознакльные найдут здесь интересные факты, а практичные читатели — полезные советы и рекомендации.
Книга по химии для домашнего чтения - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
«Сверхкислоты», или «суперкислоты», — это жидкости, являющиеся во много раз более сильными (в 10 6–10 10раз), чем общепризнанные сильные кислоты — азотная HNO 3, серная H 2SO 4, хлороводородная НСl. Сверхкислоты не терпят присутствия растворителей, служащих источниками гидроксид-ионов (таких как вода, спирты и т. п.). К сверхкислотам относят фторотриоксосульфат(VI) водорода HSO 3F, полисерные кислоты — дисерную H 2S 2O 7, трисерную H 2S 3O 10, гексафторостибат(V) водорода H[SbF 6], а также растворы сильных «кислот Льюиса» («жестких кислот») в подходящей кислоте Брёнстеда, например раствор пентафторида мышьяка AsF 5во фтороводороде HF или фторотриоксосульфате(VI) водорода.
«Магическая кислота» — это одна из суперкислот, представляющая собой эквимолярную смесь HSO 3F и пентафторида сурьмы SbF 5.
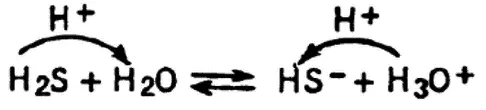
Примечание: Гильберт-Ньютон Льюис (1875–1946) — американский физикохимик, член Национальной академии наук США. Йоханнес-Николаус Брёнстед (1879–1947) — датский физикохимик, член Датского королевского общества.
3.12. «СОЛЕНЫЙ СПИРТ»
Химики употребляли в XVIII–XIX вв. в России химические названия: «соленый» (или «соляной») спирт, «морская кислота», «водотворнохлорная кислота», «оводотворенная кислота», «водохлорная кислота». Есть ли между ними что-то общее?
Так называли одно и то же вещество — водный раствор хлороводорода НСl, или хлороводородную кислоту. А в 1790 г. русский академик Лаксман (см. 1.7) ввел для этого вещества название «соляная кислота»; правда, широкое применение этот термин нашел лишь в конце XIX в. Сейчас рекомендуют водные растворы хлороводорода называть не соляной, а хлороводородной кислотой.
3.13. «КОРОЛЕВСКАЯ ВОДКА»
Являются ли винным спиртом вещества, которые 100–200 лет тому назад называли «вторичной водой», «царской водкой», «королевской водкой»?
Под такими названиями известен один и тот же реактив — смесь концентрированных кислот: одного объема азотной кислоты HNO 3с тремя-четырьмя объемами хлороводородной кислоты НСl. В смеси этих двух кислот устанавливается равновесие
причем хлор находится в растворенном состоянии.
Ломоносов (см. 2.1) называл этот реактив «королевской водкой», но чаще в литературе встречается термин «царская водка», причем первые упоминания на этот счет были уже в сочинениях арабских алхимиков VIII в. Свое название «царская водка» получила благодаря способности взаимодействовать с золотом — «царем металлов» (не проводите подобные опыты, не прочитав 5.39). Полагают, что эту способность впервые обнаружил в 1270 г. итальянский монах- францисканец, философ, алхимик и кардинал Джованни Фиданци — «Бонавентура» (1221–1274). Взаимодействие золота с «царской водкой» вызвано следующими реакциями:
В первой из этих реакций образуется трихлорид золота, во, второй — тетрахлороаурат водорода, в третьей при распаде хлорида нитрозила появляется в растворе атомарный хлор, также воздействующий на золото (четвертая реакция); в последней реакции образуется тетрахлороаурат нитрозилия.
От «царской водки» трагически погиб Александр Николаевич Радищев. В начале сентября 1802 г. он очень плохо себя чувствовал и принял лекарство, которое надо было запить водой. На столе стоял стакан с прозрачной бесцветной жидкостью, которую Радищев выпил залпом. Но это была не вода, а «царская водка», приготовленная его старшим сыном для чистки старых эполет. На следующий день Радищева не стало…
3.14. СТРАННАЯ ФОРМУЛА
Мы привыкли, что формулы кислот следует писать, начиная с атома водорода, например HNO 3(азотная кислота), H 2SO 4(серная кислота). Почему же тогда формулу борной кислоты B(OH) 3записывают иначе?
Современная формула борной кислоты B(OH) 3отвечает поведению борной кислоты в водном растворе:
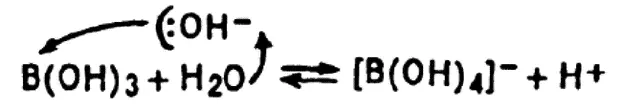
Борная кислота не выделяет протон, как все «обычные» кислоты, а отрывает от воды гидроксид-ион: она является кислотой Льюиса (см. 3.11).
Иначе, чем другие кислоты, взаимодействует борная кислота и с гидроксидами щелочных металлов:
В этих реакциях образуются не простые соли типа K 3BO3, а комплексные: в первой реакции — тетрагидроксоборат калия, во второй — пентаоксотетрагидроксотетраборат калия.
Интересно отметить, что современная химическая номенклатура предусматривает различное расположение в формулах символов атомов водорода, обладающих кислотной функцией (присоединенных к центральному атому молекулы кислоты через атом кислорода) и не обладающих кислотной функцией (присоединенных непосредственно). Например, в молекулах фосфорноватистой кислоты — диоксодигидрофосфата(I) водорода H(PH 2O 2) — и фосфористой кислоты — триоксогидрофосфата(III) водорода H 2(PHO 3) — отщепляться в водном растворе могут только соответственно один или два атома водорода. Соответственно фосфорноватистая кислота считается одноосновной, может образовывать соли состава, например, K(PH 2O 2), фосфористая — двухосновной, образующей соли типа K 2(PHO 3).
3.15. ГАС ГЕЛЬМОНТА
Долгое время в древнерусской литературе, начиная с X в., употребляли слово «гас».
Славянское слово «гас» означало газ — газообразное состояние вещества — и происходило от слова «гасить», т. е. «тушить». Например, гасить свечу, выдувая из легких «гас».
Понятие «газ» впервые в науку ввел голландский доктор медицины, алхимик и теолог Иоганн-Баптист ван-Гельмонт (1579–1644).
Ван-Гельмонт любил измерять массы и объемы продуктов химических реакций. Он сжег однажды 62 фунта (около 20 кг) угля и получил примерно один фунт золы. Тогда он сделал вывод: «Следовательно, остальные 61 фунт превратились в “лесной дух”… Этот дух я называю новым именем — газ». Ван-Гельмонт стал настойчиво искать газ в других реакциях. Он обнаружил, что газ выделяется при брожении молодого вина, при действии кислот на мел. Состава своею газа Ван-Гельмонт не знал. Только через 100 с лишним 1ет выяснили, что газ Ван-Гельмонта — диоксид углерода CO 2, имевший еще два имени — «угольный газ» и «углекислый газ».
3.16. ВОДОРОД ХЛОРОВИЧ…
В одной из рукописей, относящихся к 1870 г., можно прочитать: «Водород хлорович взаимодействует с глиноземием с образованием глиноземия хлоровича». Что за странные имена?
В 1870–1875 гг. в Петербургской академии наук обсуждалась возможность использования для названий химических веществ таких сочетаний слов, которые напоминали бы русские фамилии и отчества. Например, для воды H 2O предлагалось название «водород кислородович», для хлорида калия KCl — «калий хлорович» или «потассий хлорович», для хлороводородной кислоты HCl — «водород хлорович», для оксохлората калия KClO — «калий хлорович кислов», для триоксохлората калия KClO 3— «калий хлорович трехкислов» и т. п. В приведенных нами строках рукописи говорилось о взаимодействии алюминия («глиноземия») с хлороводородной кислотой HCl:
Читать дальшеИнтервал:
Закладка:










