Борис Степин - Книга по химии для домашнего чтения
- Название:Книга по химии для домашнего чтения
- Автор:
- Жанр:
- Издательство:Химия
- Год:1994
- Город:М.
- ISBN:5-7245-0708-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Борис Степин - Книга по химии для домашнего чтения краткое содержание
В виде небольших рассказов, заметок и ответов на вопросы приведены сведения из различных разделов химии и эпизоды из жизни ученых-химиков. Цель книги — дать читателю представление о химии как о необходимом звене, гармонично связывающем нас с природой, позволяющем создавать необходимые цивилизованному миру предметы и материалы.
Книга рассчитана на широкий круг читателей — преподавателей и студентов, школьников и пенсионеров, инженеров и домохозяек. Любознакльные найдут здесь интересные факты, а практичные читатели — полезные советы и рекомендации.
Книга по химии для домашнего чтения - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Первая реакция отвечает горению фосфора, вторая — образованию ортофосфорной кислоты H 3PO 4, а третья — превращению белого фосфора в красный (см. 5.72).
6.14. «ЛЮБОВЬ» МОНООКСИДА АЗОТА К КИСЛОРОДУ
На воздухе, в обычных условиях, NO легко присоединяет кислород:
Но при температуре выше 500°C монооксид азота разлагается на азот и кислород с выделением энергии в форме теплоты. Поэтому при 900°C зажженный фосфор продолжает гореть в монооксиде азота, отнимая кислород и превращаясь в оксид фосфора с выделением азота:
6.15. ЗЕЛЕНЫЙ ОГОНЬ
Удивительный зеленый цвет пламени костра озадачил путешественников, остановившихся на ночлег. Как вы считаете, чем могла быть вызвана необычная окраска пламени?
Зеленая окраска пламени может быть обусловлена наличием примесей в топливе или материале очага. Зеленый цвет пламени сообщают соединения меди Cu, бария Ba и бора В.
Производные бора так и обнаруживают в испытуемом материале в химической лаборатории: для получения летучего борно-этилового эфира сначала добавляют к образцу этанол C 2H 5OH и серную кислоту H 2SO 4:
а потом поджигают смесь, которая горит красивым зеленым пламенем:
Возможно, под костром путешественников оказались борсодержащие минералы.
6.16. МОЖЕТ ЛИ ГОРЕТЬ САХАР?
Сахар, или сахароза, C 12H 22O 11(см. 1.61) в обычных условиях не горит. Если поднести к куску сахара зажженную спичку, то сахар будет плавиться, но не загорится. Но если на кусок сахара насыпать совсем немного пепла от сигареты или папиросы и снова поднести огонь, то сахар загорится синевато-желтым пламенем с небольшим потрескиванием:
Суть происходящего изменения в поведении сахарозы состоит в том, что зола табака, содержащая соли щелочных металлов, в основном карбонаты, катализирует процесс горения этого вещества. Считают, что главная роль здесь принадлежит катализатору карбонату лития.
6.17. «ФАРАОНОВЫ ЗМЕИ»
Получение «фараоновых змей» — это очень эффектный опыт. Тиоцианат ртути Hg(NCS) 2при поджигании дает желто-серый объемистый продукт горения, который принимает порой самую причудливую форму, подобную змее. Тиоцианат ртути разлагается на сульфид ртути HgS, нитрид углерода C 3N 4и дисульфид углерода CS 2:
Дисульфид углерода сгорает, образуя диоксид серы SO 2и диоксид углерода CO 2:
Кстати, подобный эффект можно получить, и не используя ядовитых солей ртути. Для этого надо смешать и растереть в ступке дихромат калия K 2Cr 2O 7, нитрат натрия NaNO 3и сахар C 12H 22O 11. Затем смесь следует увлажнить и смешать с коллодием. Если теперь поджечь смесь с одной стороны, то вспыхивает едва заметный огонек и начинает «выползать» сначала черная, а после остывания — зеленая «змея»:
Если поджечь смесь дихромата аммония и нитрата аммония, то из нее начинает «выползать змея» зеленого цвета. При увеличении доли нитрата аммония «змея» растет медленнее. При нагревании дихромат аммония и нитрат аммония разлагаются:
но сначала влажный нитрат аммония плавится, скрепляет частицы зеленого оксида хрома Cr 2O 3, а затем уже начинает разлагаться с выделением газа — оксида диазота N 2O.
6.18. «ГРЕМУЧАЯ РТУТЬ»
Некоторые соединения ртути могут не только гореть, но и «греметь». «Гремучая ртуть… есть образец всех взрывчатых соединений»
(Менделеев).«Гремучая ртуть», или называемый теперь фульминат ртути, Hg(CNO) 2много лет выполняла роль инициатора взрывов. Одно время она входила в состав «говардова пороха» — капсюльного состава в артиллерии. Алхимики еще во времена Авиценны (см. 1.2) были знакомы со взрывчатой способностью этого вещества. Но только английский химик Эдвард Говард (конец XVII в.) впервые детально изучил синтез и физико-химические свойства Hg(CNO) 2. Говард получал Hg(CNO) 2прямым взаимодействием ртути Hg, азотной кислоты HNO 3и этанола C 2H 5OH:
Разложение со взрывом Hg(CNO) 2происходит даже при случайном касании, а тем более при ударе, трении, нагреве:
Интересно, что сильно увлажненный фульминат ртути взрывобезопасен.
6.19. ВУЛКАН НА СТОЛЕ
Если прикоснуться горящей спичкой к кучке оранжево-красных кристаллов дихромата аммония (NH 4) 2Cr 2O 7произойдет нечто примечательное: начинается «извержение» маленького «вулкана». Из центра стремительно вылетают раскаленные докрасна частицы «пепла», размеры «вулкана» быстро увеличиваются.
Дихромат аммония (NH 4) 2Cr 2O 7содержит атомы азота в низшей степени окисления (III) и хрома — в высшей степени окисления (+VI). Между этими атомами при поджигании происходит внутримолекулярный обмен электронами:
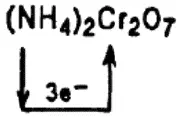
или
Эта реакция является экзотермической, протекающей с большим выделением энергии. Раскаленные частицы и зеленоватый «пепел» — это частицы оксида хрома Cr 2O 3, выбрасываемые при разложении дихромата аммония газообразным азотом N 2.
6.20. КАК ДОБЫТЬ ВОДОРОД?
Полки аэростатов заграждения блокадного Ленинграда обеспечивал водородом один из небольших химических заводов города, где добывали водород устаревшим железопаровым способом (см. 1.42). Водяной пар пропускали через раскаленное железо:
Водорода для наполнения аэростатов постоянно не хватало, и приходилось использовать походные армейские установки, в которых для получения водорода использовали взаимодействие аморфного кремния Si с гидроксидом натрия:
Воздух постоянно просачивался в наполненные водородом аэростаты. Когда концентрация водорода падала до 83%, аэростат уже становился взрывоопасным (смесь водорода и воздуха при соотношении 4:1 взрывается). Ленинградцы экономили водород как могли: ведь для производства каждого кубометра его требовались дефицитное топливо и реактивы; было даже предложено использовать отработанный водород как топливо для автомобильных двигателей.
6.21. ГИДРИДЫ — ИСТОЧНИКИ ВОДОРОДА
Вещества типа гидридов дают возможность получить водород в полевых условиях (см. 5.62). Дополнительно потребуется только вода, но это, как правило, не проблема. Из 1 кг гидрида кальция CaH 2или гидрида лития LiH (сухого вещества) можно получить 1,1–3,2 м 3водорода:
Читать дальшеИнтервал:
Закладка:










