Валерий Крылов - Каталитический риформинг бензинов. Теория и практика
- Название:Каталитический риформинг бензинов. Теория и практика
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2021
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Валерий Крылов - Каталитический риформинг бензинов. Теория и практика краткое содержание
В книге представлен анализ теоретических и практических положений технологии процесса каталитического риформинга бензиновых фракций. Изложен опыт и приведены лучшие практики эксплуатации современных установок риформинга.
Книга предназначена для инженерно-технических работников нефтеперерабатывающих заводов, проектных организаций, преподавателей и студентов вузов.
Каталитический риформинг бензинов. Теория и практика - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Прочность донорно-акцепторной и дативной связи увеличивается с уменьшением различия в энергии донорной и акцепторной орбиталей в соответствии с величиной энергии стабилизации 106; 107:
Δ Е стаб~ S 2/Δε,
где S – интеграл перекрывания; Δε – разница в энергии исходных орбиталей.
При переносе электронной плотности с π-орбитали этилена происходит накопление положительного заряда в молекуле, что ограничивает перенос электронов, в то же время обратный перенос с занятых орбиталей металла нейтрализует этот заряд, и позволяет продолжить формирование более прочной донорно-акцепторной связи.
В свою очередь передача электронной плотности с молекулы на металл увеличивает донорные свойства металла.
В итоге имеет место синергизм, который приводит к образованию более прочной связи металла и молекулы и более значительному ослаблению связи в молекуле.
Для комплексов Цейзе и Караша связывание является слабым из-за пониженного дативного потенциала положительно заряженных ионов платины и палладия.
Результатом рассмотренных взаимодействий является уменьшение порядка и прочности углерод-углеродной связи в молекуле, что коррелирует с увеличением длины связи и со смещением пиков инфракрасного поглощения в длинноволновую область спектра.
Так, длина связи С–С увеличивается со 133,7 пм в свободной молекуле этилена до 137,0 пм в комплексе платины и этилена и до 148,0 пм в комплексе этилена и никеля Ni(CO) 4[37].
Квантово-механический анализ взаимодействия на примере связывания молекулы СО и переходных металлов первой серии (3 d -металлы) представлен в [106].
Электронная структура молекулы СО представлена на рис. 20.
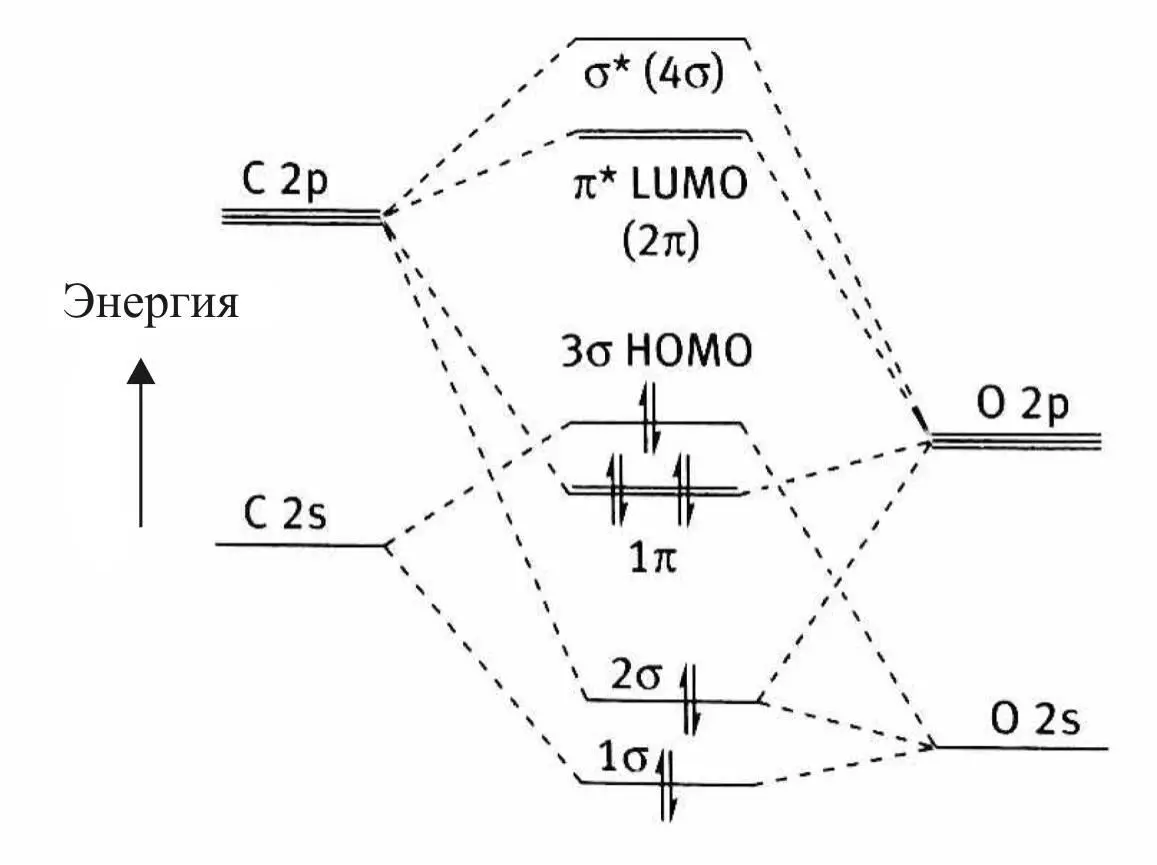
Рис. 20. Электронная структура молекулы СО:
HOMO – high occupated molecular orbital;
LUMO – low unoccupated molecular orbital
В образовании связей в молекуле принимают участие
1σ-орбиталь и две 1π-орбитали.
Молекулярные орбитали 2σ и 3σ не вносят вклада в связывание и являются фактически не поделенными электронными парами кислорода и углерода соответственно.
На самом деле орбиталь 3σ является слегка разрыхляющей орбиталью для молекулы. Эта орбиталь участвует в донорно-акцепторном связывании с d -металлом в качестве донора электронов.
Особенностью электронного строения молекулы СО является несимметричное распределение электронной плотности между лепестками π- и π*-МО. Несимметричность обусловлена различиями в электроотрицательности и в уровнях энергии атомов углерода и кислорода, образующих молекулу.
π-МО является связующей в молекуле, и по энергии она ближе к энергии p -AO кислорода, в связи с чем электронная плотность смещена в лепесток у атома кислорода.
π*-орбиталь как разрыхляющая орбиталь молекулы ближе по энергии к p - орбитали атома углерода, что обусловливает концентрацию электронной плотности орбитали в лепестке у атома углерода (рис. 21).
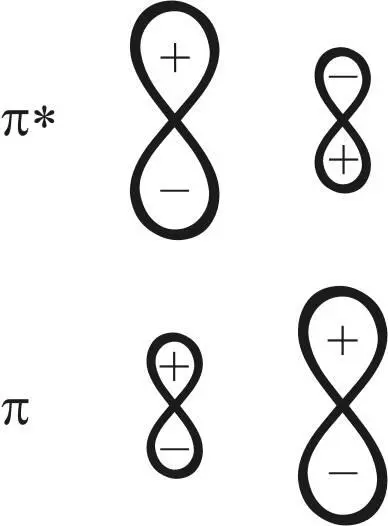
Рис. 21. Электронные схемы π*-, π-орбитали
В связи с тем что σ-связывание с металлом происходит через атом углерода, подобное несимметричное распределение π-электронной плотности более благоприятно для связывания dxz -орбитали металла с π*-орбиталью (рис. 22).
Расчетное отношение интегралов перекрывания для π- и π*-орбиталей составляет 1,78 в пользу π*-орбитали.
Поскольку энергия стабилизации при образовании связи пропорциональна квадрату интеграла перекрывания, то выигрыш в энергии при образовании связи с π*-орбиталью больше в 3,2 раза. Такой выигрыш благоприятен для проявления π-акцепторного характера π*-МО. Вместе с тем необходимо учитывать различие в энергиях орбиталей Δε.
Значения Δε представлены в табл. 5.
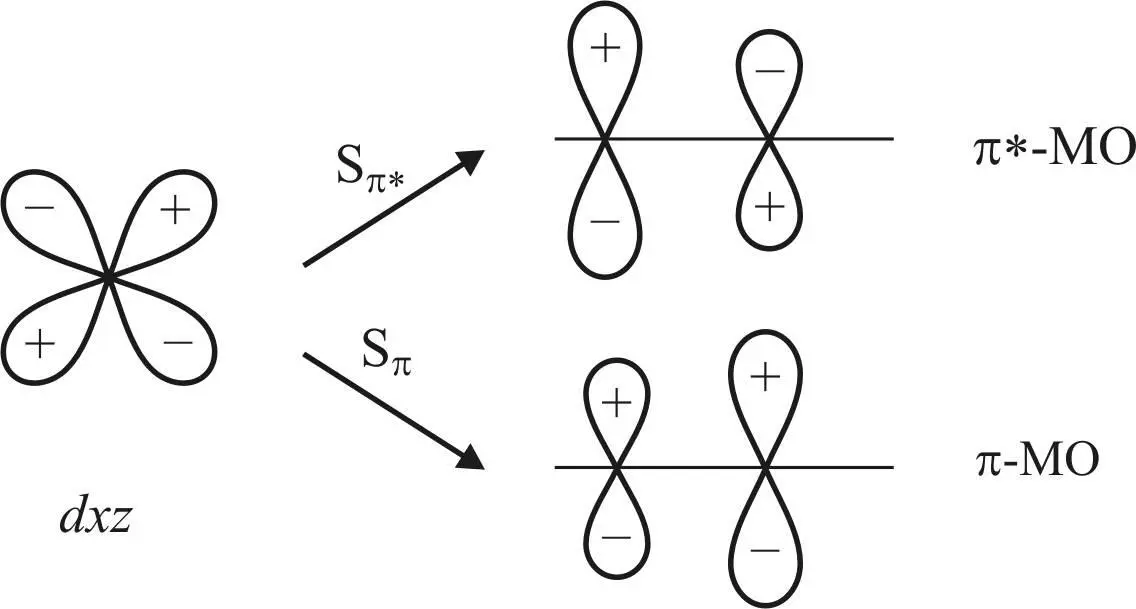
Рис. 22. Схема dxz -орбиталей атома металла
с π*-МО и π-МО молекулы СО
Таблица 5
Энергетические уровни d -металлов
и орбиталей молекулы СО [106]
Энергия
Sc
Ti
V
Cr
Mn
Fе
Co
Ni
Сu
d
–8,5
–10,8
–11,0
–11,2
–11,7
–12,6
–13,2
–13,5
–14,0
7,2
4,9
4,7
4,5
4,0
3,1
2,5
2,2
1,7
*
–0,6
1,7
1,9
2,1
2,6
3,5
4,1
4,4
4,9
П р и м е ч а н и е : ε d – энергия d -электронов в атоме металла.
Напомним, что нулевому энергетическому уровню соответствует состояние электрона, находящегося на таком удалении от ядра, когда можно пренебречь электростатическим взаимодействием электрона и ядра атома.
При приближении электрона к ядру его потенциальная энергия падает, поэтому чем больше по величине отрицательное значение ε d , тем ниже энергия электрона.
Для металлов в левой части периода d –π*-взаимодействие оказывается сильнее d –π-взаимодействия, и для этих металлов молекула СО выступает как акцептор электронов.
Для металлов в правой части периода разница в энергии благоприятствует проявлению донорного характера π-связи, однако больший интеграл перекрывания с π*-связью приводит все же к тому, что молекула остается π-акцептором электронов.
При переходе к металлам второго и третьего периодов происходит подъем энергетического уровня d -электронов, что приводит к сближению π*-МО и d -электронов и увеличению
π-акцепторного характера молекулы СО (табл. 6).
Таблица 6
Энергетические уровни d -орбиталей первого, второго
и третьего переходного периодов [106]
Первый период
Sc
Ti
V
Cr
Mn
Fе
Co
Ni
Сu
Zn
3 d
–7,92
–9,22
–10,11
–10,74
–11,14
–11,65
–12,12
–12,92
–13,46
–17,29
4 d
–6,60
–7,11
–7,32
–7,45
–7,83
–7,90
–8,09
–8,22
–8,42
–9,39
Второй период
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Аg
Cd
4 d
–6,48
–8,30
–8,85
–9,14
–9,25
–9,31
–9,45
–9,58
–12,77
–17,85
3 d
–6,70
–7,31
–7,22
–7,24
–7,21
–7,12
–7,28
–7,43
–7,57
–8,99
Третий период
Lu
Hf
Та
W
Re
Os
Ir
Pt
Au
Hg
5 d
–5,28
–6,13
–7,58
–8,76
–9,70
–10,00
–10,21
–10,37
–11,85
–15,58
6 d
–7,04
–7,52
–8,45
–8,51
–8,76
–8,81
–8,83
–8,75
–9,22
–10,43
П р и м е ч а н и е : приведенные значения энергий рассчитаны на базе спектроскопических данных.
Формально образование связей с атомом металла может быть представлено уравнением с использованием структур Льюиса:
Структура образующегося комплекса является резонансом двух указанных структур. Обе структуры имеют меньшую энергию, чем исходные реагенты: первая за счет образования новой связи, а вторая стабилизирована дополнительно, потому что в ней отсутствует разделение зарядов.
Читать дальшеИнтервал:
Закладка:









