Валерий Крылов - Каталитический риформинг бензинов. Теория и практика
- Название:Каталитический риформинг бензинов. Теория и практика
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2021
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Валерий Крылов - Каталитический риформинг бензинов. Теория и практика краткое содержание
В книге представлен анализ теоретических и практических положений технологии процесса каталитического риформинга бензиновых фракций. Изложен опыт и приведены лучшие практики эксплуатации современных установок риформинга.
Книга предназначена для инженерно-технических работников нефтеперерабатывающих заводов, проектных организаций, преподавателей и студентов вузов.
Каталитический риформинг бензинов. Теория и практика - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
W = E n – E 1.
Важной характеристикой зоны является плотность состояний ρ – это отношение числа энергетических уровней в интервале энергии Δ Е к этому интервалу. Максимальная плотность состояний достигается в центральной части зоны, минимальная – на краях зоны, где существует единственный способ образования полностью разрыхляющих и полностью связующих орбиталей.
Заполнение зоны происходит в соответствии с принципом Паули, то есть на каждой молекулярной орбитали независимо от ее протяженности может находиться максимум два электрона. Степень заполнения зоны зависит от количества d - электронов атома. Верхний уровень энергии, занятых МО при температуре 0 К, носит название уровня Ферми (ε f ).
При Т > 0 электроны занимают более высокие уровни,
и заселенность орбиталей определяется распределением Ферми – Дирака.
Очевидно, что энергия орбиталей, находящихся выше середины зоны, будет ближе к уровням акцепторных орбиталей молекул, чем у орбиталей свободных атомов металла.
Таким образом, образование d - зоны обеспечивает более сильное дативное взаимодействие, которое увеличивается при подъеме уровня Ферми.
Компактность d - зоны и высокая плотность состояний позволяют рассматривать d - зону как одну молекулярную орбиталь, взаимодействующую с молекулой адсорбата с образованием связующей и разрыхляющей орбиталей. Подробное описание модели сильной связи приведено в [26; 54].
Современные представления об образовании химической связи между адсорбатом и поверхностью d - металла разработаны Хофманом и доступно изложены в его книге [25].
Рассмотрим, что происходит, когда молекула адсорбата, в нашем случае молекула СО, подходит к поверхности переходного металла.
Электронная структура молекулы рассмотрена ранее. Верхней заполненной орбиталью в молекуле является 3σ.
Эта орбиталь в основном локализована на атоме углерода и может рассматриваться как неподеленная электронная пара
углеродного атома. Указанные свойства 3σ-МО позволяют участвовать в образовании σ-связи с молекулярными орбиталями аналогичной симметрии, локализованными в верхней части d - зоны переходного металла. Такими МО являются орбитали, образованные из атомных dz 2.
Вакантной орбиталью с самой низкой энергией в молекуле СО является разрыхляющая 2π-МО. 2π-орбиталь имеет узловую плоскость и способна к π-перекрыванию с МО d - зоны, которые образованы атомными орбиталями dxz и dyz , также имеющими узловую плоскость.
Особенностью 2π-орбитали является неравномерное распределение электронной плотности в лепестках орбитали.
Поскольку большая часть электронной плотности сконцентрирована в лепестке орбитали, локализованном у атома углерода, то максимальное перекрытие с орбиталями металла достигается в случае, когда приближающаяся молекула СО своей осью ориентирована перпендикулярно поверхности металла.
Схема взаимодействия орбиталей молекулы и металла при образовании донорно-акцепторной и дативной связи представлена на рис. 27.
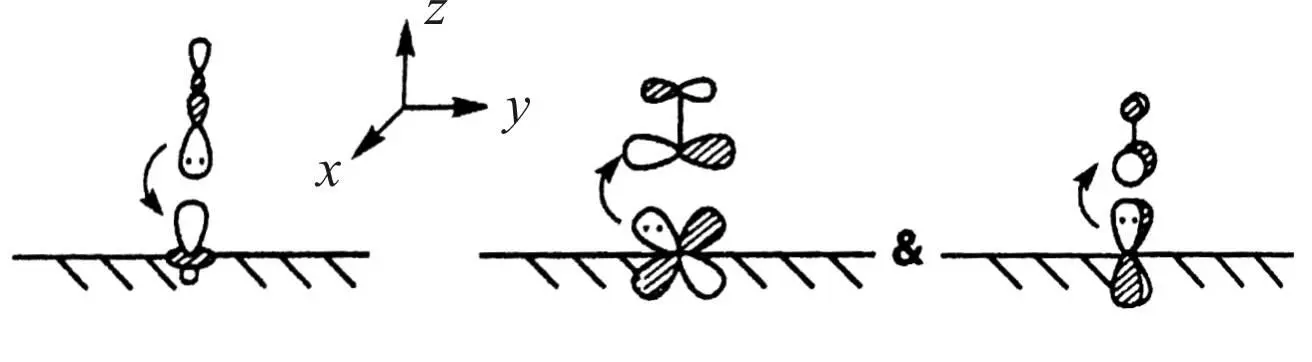
Рис. 27. Схема взаимодействия орбиталей молекулы и металла
при образовании донорно-акцепторной и дативной связи
Существенным при рассмотрении взаимодействия является то, что 3σ-МО имеет уровень энергии ниже уровня Ферми и поэтому может перекрываться только с заполненными dz 2-орбиталями металла.
При приближении молекулы к поверхности возникает взаимодействие между 3σ-орбиталью и заполненными орбиталями d - зоны, которое приводит к расщеплению исходных уровней энергии с образованием двух новых энергетических уровней, соответствующих связующей и разрыхляющей орбиталям.
Поскольку это взаимодействие заполненных орбиталей, то новые орбитали будут также заполнены (рис. 28).
В случае взаимодействия молекул нетто-результат 4-электронного 2-орбитального взаимодействия однозначен – отсутствие связывания из-за заполнения образующейся разрыхляющей орбитали. При взаимодействии с d - зоной этот результат зависит от того, насколько сильным будет расщепление уровней энергии. Чем ближе уровни энергии орбиталей и чем ближе молекула подходит к поверхности, тем больше интеграл перекрывания орбиталей и энергия стабилизации, определяющая расщепление.
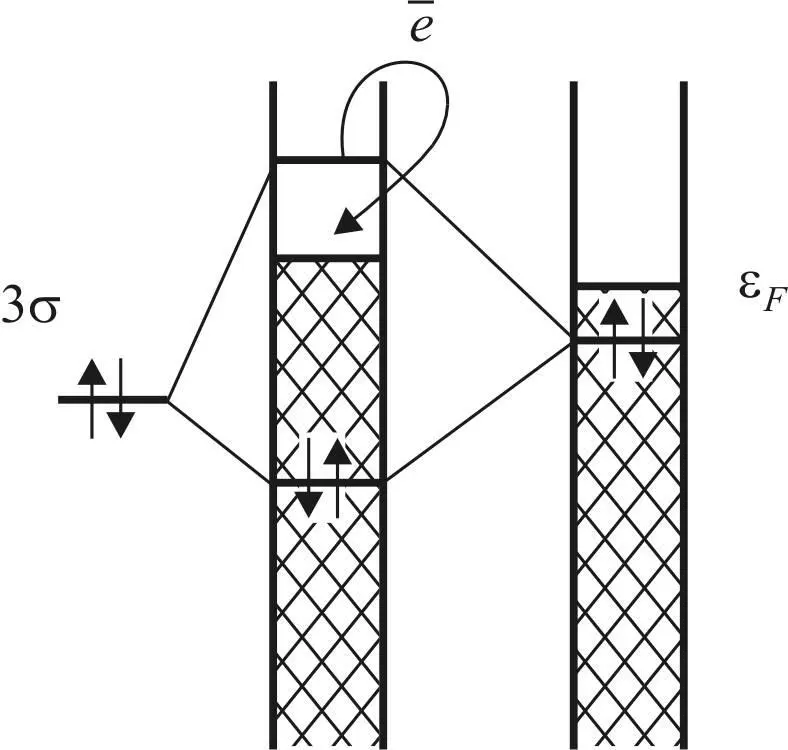
Рис. 28. Взаимодействие 3σ-орбиталей
и электронной d - зоны [25]
При достаточно сильном расщеплении уровень новой разрыхляющей орбитали достигает уровня Ферми, и тогда электроны с этой орбитали могут быть сброшены в d - зону, где они займут пустые уровни.
Рассмотренные 4-электронные взаимодействия показаны на рис. 29, где а соответствует взаимодействию двух молекул, б – молекулы с поверхностью металла.
Эти пустые орбитали локализованы на поверхности металла и являются разрыхляющими орбиталями. Заполнение их приводит к ослаблению связей между поверхностными атомами металла и является причиной часто наблюдаемой реконструкции поверхности при хемосорбции.
В результате взаимодействие в системе «молекула – поверхность» из отталкивающего переходит в связующее с образованием связи молекулы с металлом.
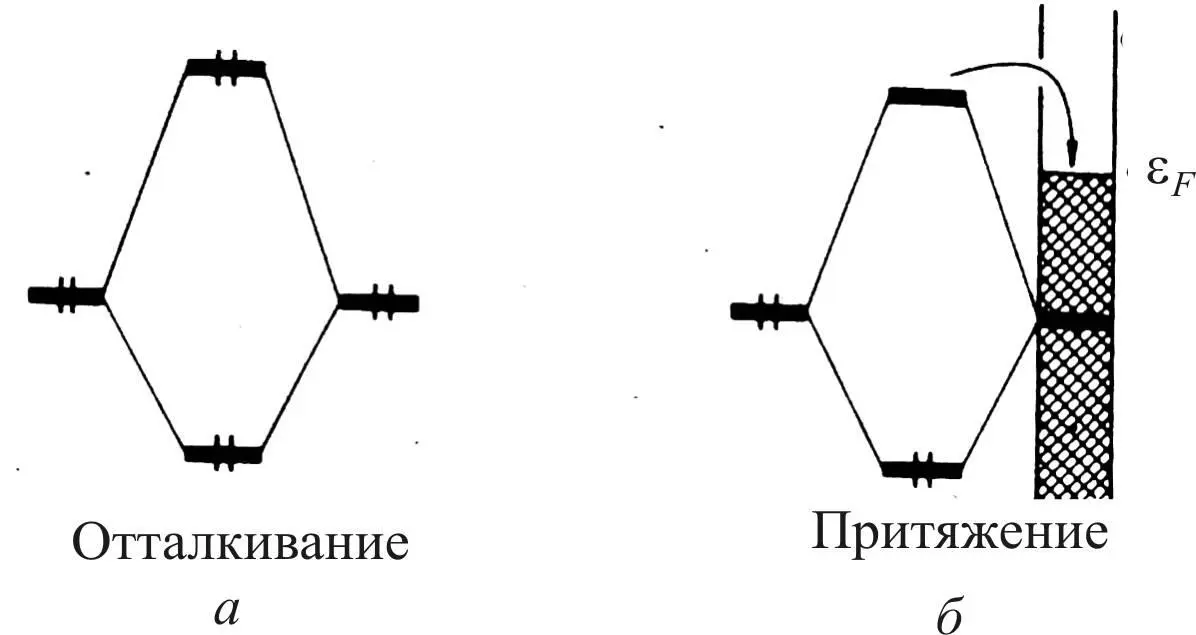
Рис. 29. Схема 4-электронных взаимодействий:
а – двух молекул; б – молекулы с поверхности металла [25]
Расчеты с использованием расширенного метода Хюккеля для адсорбции СО на поверхности никеля показывают, что молекула СО теряет 0,38 электрона. В итоге заселенность 3σ-орбитали снижается с 2,0 до 1,62.
Выигрыш энергии при образовании связи зависит от параметров d - зоны металла и пропорционален выражению
,
где f – степень заполнения d - зоны; ε d и ε 3σ– уровни энергии центра d - зоны и 3σ-орбитали молекулы СО; β – резонансный интеграл [26].
Как следует из данного выражения, выигрыш энергии увеличивается при сближении уровней энергии орбиталей и уменьшения степени заполнения d - зоны.
Схема образования дативной π-связи представлена на рис. 30.
Поскольку уровень энергии 2π-орбитали выше уровня Ферми, то максимальное расщепление будет наблюдаться в случае перекрывания орбитали с одной из вакантных МО d - зоны, расположенной над уровнем Ферми.
Заметим, что при взаимодействии молекул новые орбитали останутся незаполненными, и связь не образуется. В случае связывания молекулы с поверхностью металла d - зона играет роль резервуара, из которого происходит заполнение меньшей по энергии орбитали с образованием химической связи. При этом на разрыхляющую орбиталь молекулы СО поступает 0,74 электрона. Расчеты показывают, что эти электроны поступают на 2π-орбиталь с внутренних xz - и yz -орбиталей зоны, при этом эти донорные орбитали не остаются пустыми, а заполняются электронами с поверхности металла.
Читать дальшеИнтервал:
Закладка:









