Валерий Крылов - Каталитический риформинг бензинов. Теория и практика
- Название:Каталитический риформинг бензинов. Теория и практика
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2021
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Валерий Крылов - Каталитический риформинг бензинов. Теория и практика краткое содержание
В книге представлен анализ теоретических и практических положений технологии процесса каталитического риформинга бензиновых фракций. Изложен опыт и приведены лучшие практики эксплуатации современных установок риформинга.
Книга предназначена для инженерно-технических работников нефтеперерабатывающих заводов, проектных организаций, преподавателей и студентов вузов.
Каталитический риформинг бензинов. Теория и практика - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Порядок связи в результирующей структуре находится между 3 и 2, то есть меньше, чем в исходной молекуле, что также свидетельствует, что образование связей с атомом металла приводит к ослаблению связи в молекуле СО. При переходе от концевых к мостиковым группам связь в молекуле СО ослабевает еще больше, что проявляется в смещении ИК-поглощения в длинноволновую часть спектра (рис. 23) [37].
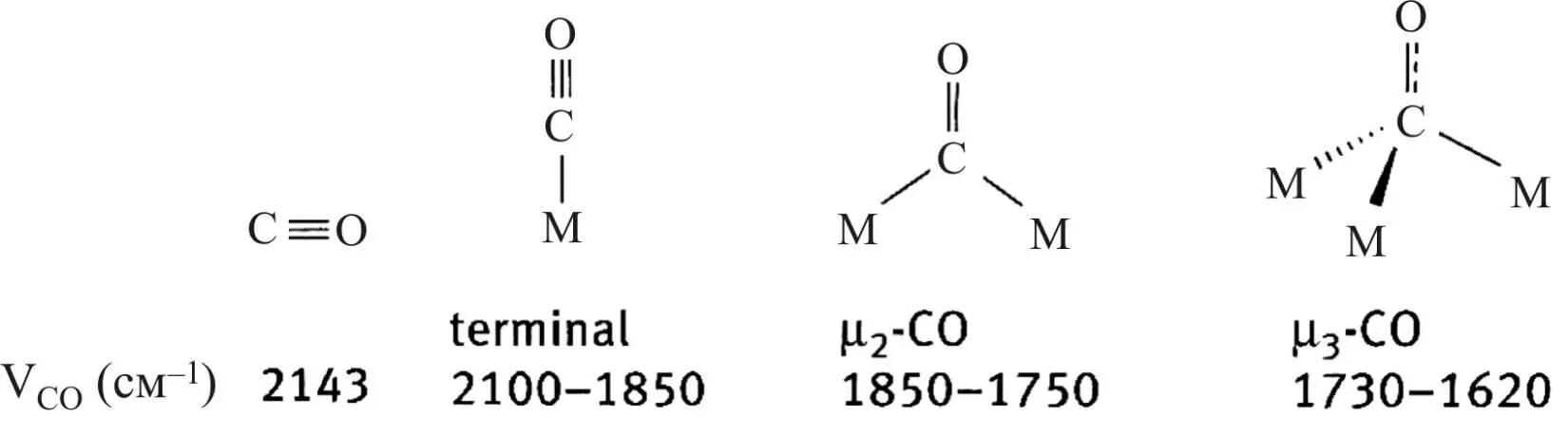
Рис. 23. Структура адсорбционных комплексов
молекулы СО и атомов металлов
Этот пример из металлорганической химии имеет прямую аналогию в гетерогенном катализе и позволяет понять, почему увеличение размера активного ансамбля приводит к более легкому протеканию структурно-чувствительных реакций.
Сказанное выше не означает, что молекула СО не может быть донором электронов для атома металла.
Наличие в молекуле 3σ-орбитали, имеющей характер неподеленной электронной пары, причем обладающей небольшим разрыхляющим эффектом, позволяет молекуле СО выступать в качестве σ-донора по отношению к элементам, имеющим незаполненные d -орбитали.
Необходимо учитывать, что преобладающий вклад дативного взаимодействия обусловлен поляризацией связи С–О, являющейся причиной высокого значения интеграла перекрывания d –π*.
Для молекул с меньшей поляризацией связей этот эффект будет меньше или вообще отсутствовать, например, дипольный момент связи С–С равен нулю. Вместе с тем связь С–Н существенно поляризована: дипольный момент связи составляет 0,3 дебая (Д), что почти в три раза больше, чем дипольный момент молекулы СО (0,11 Д).
Такие различия в поляризации, как будет показано далее, вполне могут быть причиной различных скоростей реакций дегидрирования и гидрогенолиза углеводородов, протекающих на катализаторе платформинга.
После рассмотрения координационной связи в металлорганических соединениях перейдем к анализу взаимодействия молекул с поверхностью металла. Это взаимодействие лежит в основе химической адсорбции и определяет каталитическое действие переходных металлов.
Основным отличием взаимодействия с поверхностью является то, что молекула образует связи не с орбиталями отдельного свободного атома металла, а с энергетическими зонами, возникающими при перекрывании орбиталей отдельных атомов. Это создает дополнительные возможности для образования химической связи, как мы увидим далее.
Формирование энергетических зон может быть описано двумя различными способами.
В приближении свободных электронов (ПСЭ) или модели электронного газа, используемых в физике твердого тела, зоны формируются аналогично тому, как происходит квантование энергетических уровней электрона, помещенного в прямоугольную потенциальную яму [11; 25].
Наличие периодической решетки, образованной атомами, приводит к расщеплению континуума энергий электронов на серию зон Бриллюэна.
В приближении сильной связи (ПСС) зоны формируются при перекрывании орбиталей атомов аналогично тому, как это происходит при образовании молекулы.
На рис. 24 представлено образование s -зоны для n атомов лития. Аналогичным образом формируются s -, p – и d -зоны для d -элементов.
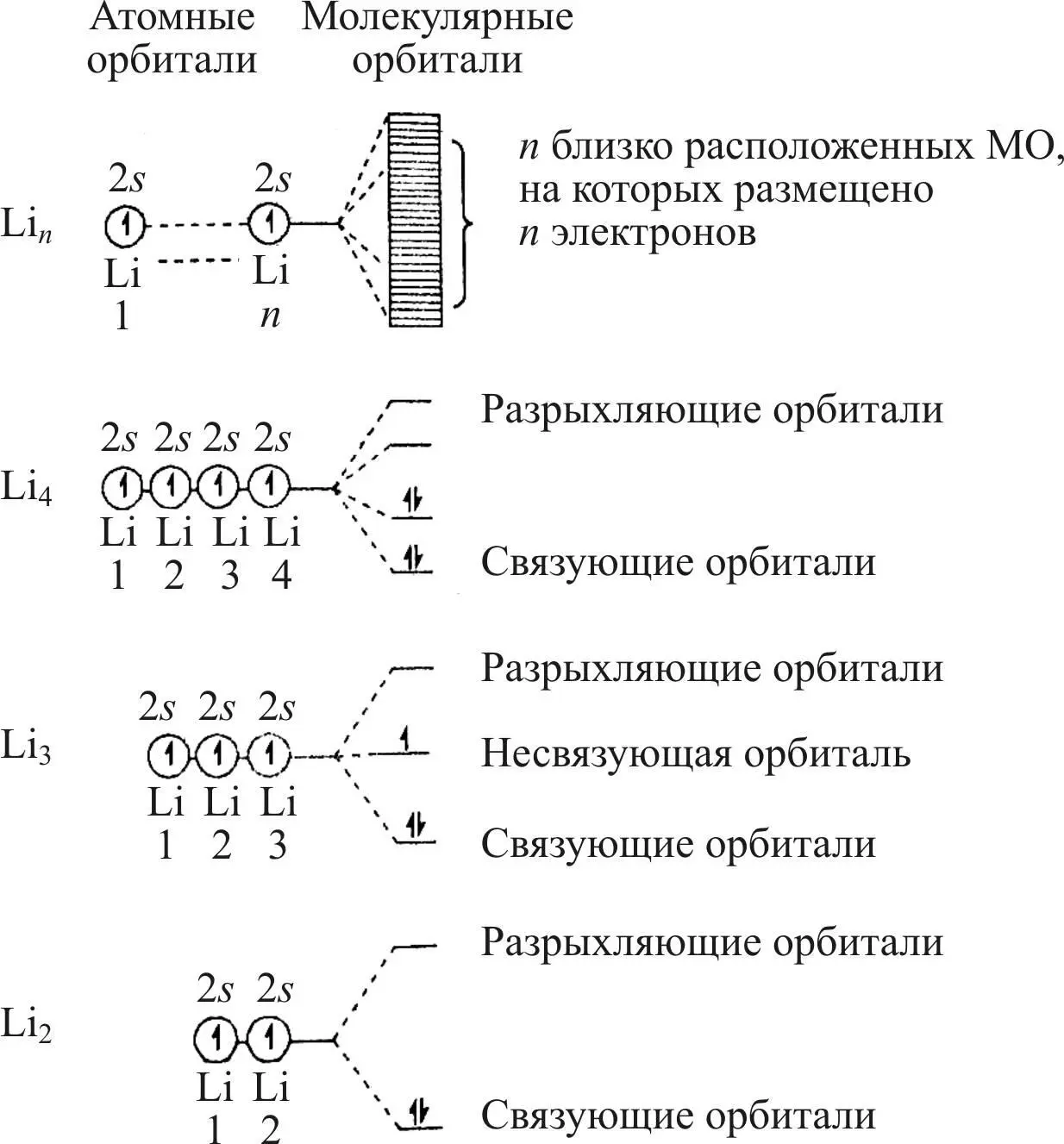
Рис. 24. Схема образования s -зоны для n атомов лития
Вследствие небольшого различия в энергиях s – и p -атомных орбиталей происходит гибридизация АО, в результате образуется одна гибридная sp -зона, как показано ниже (рис. 25).
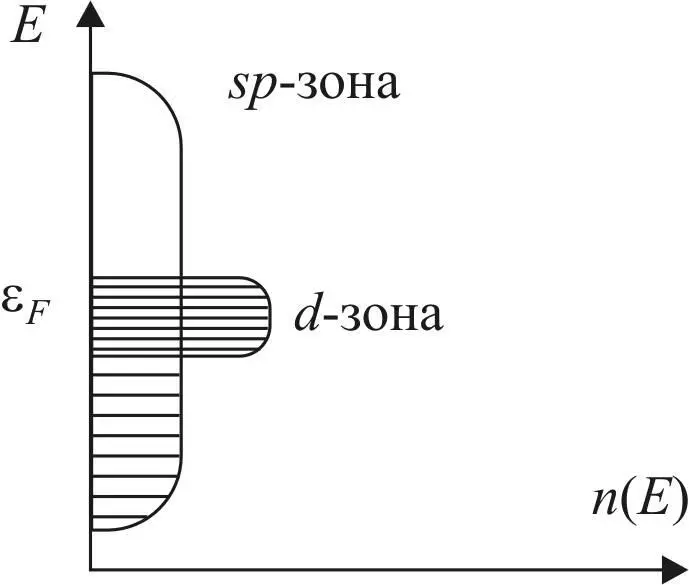
Рис. 25. Схема образования sp – и d -зон металла
50%-ный s -характер sp -орбиталей обеспечивает сильное перекрывание и расщепление энергетических уровней образующихся орбиталей, что приводит к формированию широкой зоны, правда, с маленькой плотностью электронных состояний из-за ограниченного количества s и p -электронов – максимум два электрона на атом переходного металла. Sp -зона играет важную роль в начальном взаимодействии молекулы с поверхностью, обеспечивая снижение энергии адсорбата, однако это взаимодействие не приводит к расщеплению энергетических уровней и активации молекулы и не является причиной различий каталитических свойств металлов. Эти различия обусловлены структурой d -зон переходных металлов.
В формировании d -зоны участвуют все пять атомных d - орбиталей, каждая из которых образует свою зону, состоящую из набора связующих, несвязующих и разрыхляющих орбиталей.
Наибольшее расщепление с формированием зоны самой большой ширины происходит при образовании σ-связей, в котором по соображениям симметрии могут участвовать только dz 2-орбитали.
Остальные d - орбитали участвуют в менее эффективном
π-связывании ( dyz и dzx ) и еще менее эффективном δ-связывании ( dxy и dx 2– y 2).
Энергии связующих σ-, π-, δ-МО соотносятся как 1:0,8:0,1.
Схема образования σ-, π-, δ-МО-зон представлена на рис. 26.
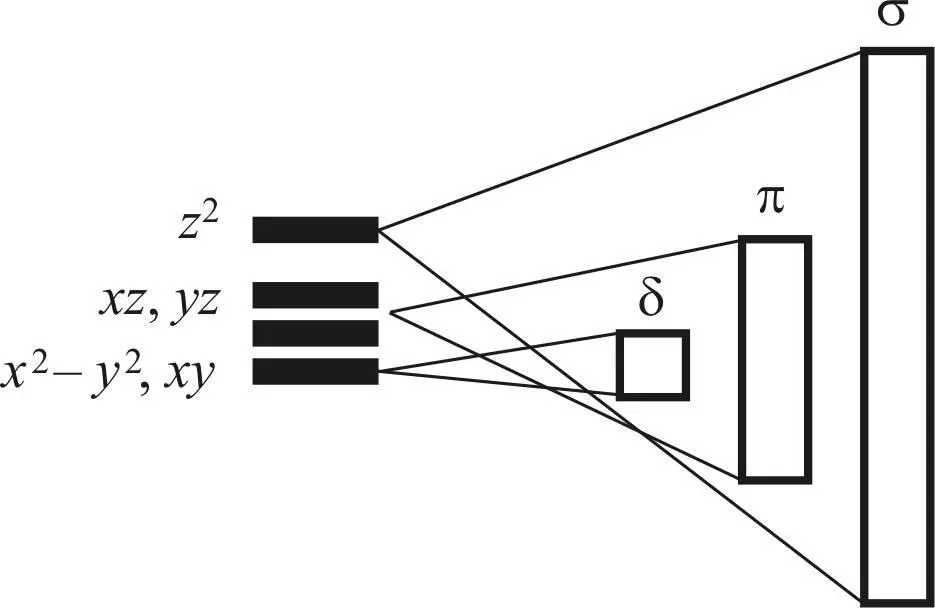
Рис. 26. Схема образования σ-, π-, δ-МО-зон [25]
Для наглядности уровни АО орбиталей разнесены. Фактически все они имеют одинаковый уровень энергии, так как являются вырожденными орбиталями с одинаковым главным квантовым числом n . В середине зоны находятся несвязывающие МО, уровень энергии которых близок к таковой атомных орбиталей. Ниже этого уровня находятся связующие МО, энергия которых увеличивается с ростом числа узловых плоскостей. Низ зоны занимают полностью связующие МО, не имеющие узловых плоскостей, разделяющих соседние атомы металла.
Связующие орбитали имеют низкий уровень энергии и являются аналогом внутренних электронов атома, не принимая участия в хемосорбции.
Верхняя часть зоны после несвязующих орбиталей занята разрыхляющими орбиталями, которые, по существу, и представляют собой валентные электроны металла, ответственные за формирование хемосорбционных связей с молекулами адсорбата.
Самые верхние орбитали зоны представлены полностью разрыхляющими σ- и π-орбиталями, образованными dz 2-, dxz - и dyz -атомными орбиталями.
Молекулярные орбитали, образованные x 2– y 2и xy –АО, находятся в центральной части зоны и не участвуют в хемосорбции.
Разница в энергиях самой верхней и самой нижней МО называется шириной зоны и вычисляется по формуле
Читать дальшеИнтервал:
Закладка:









