Валерий Крылов - Каталитический риформинг бензинов. Теория и практика
- Название:Каталитический риформинг бензинов. Теория и практика
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2021
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Валерий Крылов - Каталитический риформинг бензинов. Теория и практика краткое содержание
В книге представлен анализ теоретических и практических положений технологии процесса каталитического риформинга бензиновых фракций. Изложен опыт и приведены лучшие практики эксплуатации современных установок риформинга.
Книга предназначена для инженерно-технических работников нефтеперерабатывающих заводов, проектных организаций, преподавателей и студентов вузов.
Каталитический риформинг бензинов. Теория и практика - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:

Рис. 30. Образование дативной π-связи:
а – эффект отсутствует; б – притяжение [25]
Выигрыш энергии при формировании дативной связи зависит от параметров d - зоны металла и пропорционален выражению
,
где ε 2π– уровень энергии 2π-орбитали молекулы СО; β – резонансный интеграл [26].
Из этого выражения еще раз следует, что выигрыш энергии при образовании дативной связи увеличивается при сближении уровней энергий орбиталей металла и адсорбата и возрастания степени заполнения d - зоны.
Суммарным результатом рассмотренных взаимодействий является образование хемосорбционной связи молекулы с поверхностью металла и ослабление связей в молекуле и в металле (компенсационный эффект хемосорбции по Хофману).
Ослабление связи активирует молекулу, снижает энергию активации и является причиной каталитического действия d - металлов.
Для d - металлов, расположенных в правой части периода, образование σ-связи в большинстве случаев является второстепенным фактором активации адсорбируемой молекулы в связи с более полным заполнением зоны, основным же является образование дативной связи.
Как было показано в предыдущем рассмотрении хемосорбции молекулы СО на никеле, вакантная орбиталь адсорбата имеет более высокую энергию, чем уровень Ферми. Это справедливо и для других молекул, включая углеводороды.
В связи с этим подъем уровня Ферми приводит к сближению энергий перекрывающихся орбиталей металла и адсорбата и, следовательно, к образованию более прочной адсорбционной связи и более сильному ослаблению связи в молекуле.
Понижение уровня Ферми будет приводить к обратному результату.
Закономерности изменения характеристик d - зон переходных металлов рассмотрены ниже.
Квантово-механические расчеты положения уровня Ферми для металлов первой переходной серии (3 d -металлы) проведены впервые О. Андерсеном (рис. 31).
Описание происходящих изменений приведено по [25]: центр d - зоны и уровень Ферми при смещении вправо по переходному периоду опускаются в связи с увеличением положительного заряда атомного ядра.
Поскольку атомные d - орбитали становятся компактнее, то это приводит к уменьшению степени перекрывания, приводящему к сужению зоны. В то же время увеличивается заполнение зоны, что поднимает уровень Ферми. В конечном счете первый фактор перевешивает, что приводит к опусканию уровня Ферми.
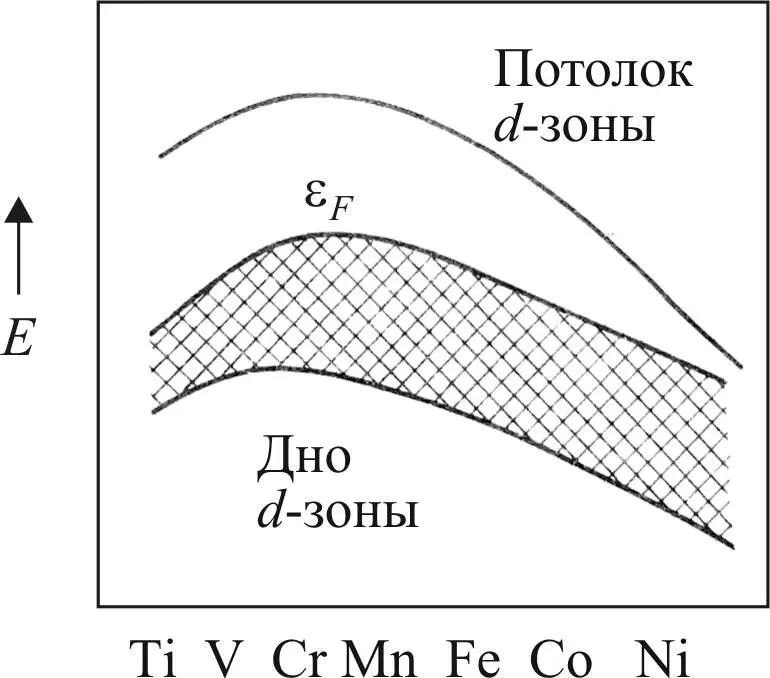
Рис. 31. Энергетические уровни d - зоны металлов
первого переходного периодов
Полученные закономерности справедливы и для металлов второй и третьей переходных серий d - металлов, а также при перемещении внутри группы сверху вниз, что представлено на графике ниже для положения центра d - зоны [26].
Как следует из рис. 32, центр зоны смещается вниз внутри периода при движении слева направо и при перемещении вниз внутри группы.
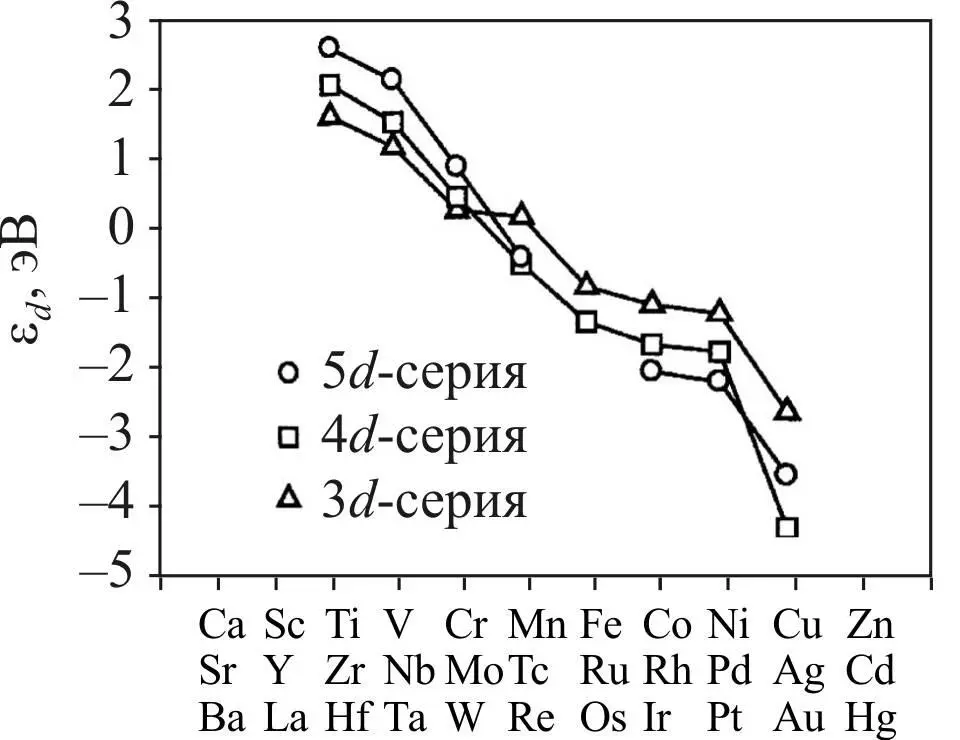
Рис. 32. Положение центра d -зоны для трех серий переходных металлов. Заметим, что центр d -зоны смещается вниз при движении вправо
по Периодической таблице. При полном заполнении d -зоны смещение ее центра вниз продолжается, и она превращается во внутренний уровень, не влияющий на химическое поведение металла [26]
При переходе от 4 d - металлов к 5 d - металлам наблюдается небольшое изменение по сравнению с переходом от 3 d - металлов, причиной которого является заполнение f -AO, происходящее на этом переходе.
Слабое экранирование ядерного заряда f -электронами приводит к лантаноидному сжатию в третьем переходном периоде.
Атомные, ковалентные и ионные радиусы 5 d - металлов лишь немногим больше, чем у 4 d - металлов, несмотря на увеличение электронной оболочки на 14 электронов.
С учетом изложенного следует важный для понимания гетерогенного катализа вывод о том, что энергия связывания адсорбата с поверхностью металла и, следовательно, степень активации молекулы уменьшаются в периоде слева направо и по группе сверху вниз. Так, металлы, расположенные в левой части переходного периода, такие как железо, рутений и уран (6 d - элемент), способны активировать такую прочную и инертную молекулу, как N 2, и являются катализаторами синтеза аммиака.
Fe, Co и Ru адсорбируют СО диссоциативно и являются катализаторами синтеза Фишера – Тропша, проходящем через образование и гидрирование С-фрагментов.
В отличие от них, Pd, Pt, Ir и Cu адсорбируют СО без диссоциации и не могут быть катализаторами этого процесса.
В ряде случаев это может быть преимуществом. Например, при синтезе метанола, где диссоциация СО не требуется, меднохромовые катализаторы нашли широкое промышленное применение и являются основными катализаторами получения метилового спирта.
Платина находится внизу группы и в конце третьего переходного периода. Оба фактора приводят к понижению уровня Ферми и обусловливают более слабое связывание с молекулами адсорбата и, следовательно, более низкую активность платины в активации реагентов по сравнению с другими переходными металлами. К примеру, никель является более активным катализатором в реакциях дегидрирования циклогексана и гидрогенолиза н-гексана, причем активность в последней реакции выше, чем в дегидрировании.
Фактором, дополнительно понижающим активность платины, является практически полное заполнение зоны, что ограничивает образование σ-связей с молекулами-донорами электронов и не позволяет реализовать синергизм, возникающий при π- и σ-взаимодействии. Однако это не означает, что платина является не лучшим выбором в качестве катализатора риформинга. Для ответа на этот вопрос необходимо рассмотреть такие не менее важные характеристики катализатора, как селективность, стабильность и чувствительность к отравлению.
Не секрет, что гетерогенные катализаторы имеют худшую селективность по сравнению с гомогенными катализаторами, что обусловлено неоднородностью поверхности и существованием на ней различных реакционных центров. В связи с этим на гетерогенных катализаторах проходят как целевые, так и побочные реакции реагентов.
Селективность металлической функции катализатора риформинга – это его способность осуществлять основные реакции дегидрирования-гидрирования без заметного протекания побочной реакции гидрогенолиза углерод-углеродной связи, которая приводит к снижению выхода С 5 +и водорода.
Читать дальшеИнтервал:
Закладка:









