Михаил Никитин - Происхождение жизни. От туманности до клетки
- Название:Происхождение жизни. От туманности до клетки
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2016
- Город:Москва
- ISBN:978-5-9614-4350-9
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Никитин - Происхождение жизни. От туманности до клетки краткое содержание
Происхождение жизни. От туманности до клетки - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Еще в 1987 году было достигнуто неферментативное копирование РНК длиной 14 нуклеотидов. Использовались нуклеотид-метилимидазол-фосфаты и водный раствор с высокой концентрацией солей магния (Acevedo, Orgel, 1987).
В последующие годы это направление исследований было практически заброшено, так как ученые переключились на искусственный отбор рибозимов. Но в последние годы Джек Шостак вернулся к неферментативному копированию, причем с новыми идеями – он пытается проводить его внутри протоклеток, т. е. пузырьков, окруженных липидной мембраной. Недавно ученицей Шостака Катаржиной Адамалой было осуществлено копирование РНК внутри протоклеток (Adamala, Szostak, 2013).
Копирование РНК без помощи ферментов имеет много недостатков, которые нам знакомы по рибозимам-полимеразам:
• в конце копирования, как и у полимеразы, образуется устойчивая двунитевая РНК, которую надо как-то расплести для следующего цикла копирования;
• скорость и точность неферментативного копирования еще хуже, чем с рибозимами: ошибок – около 10 %, а на присоединение одного нуклеотида уходит более часа.
У неферментативного копирования есть и другие проблемы, которые не свойственны рибозимам-полимеразам:
• при копировании без ферментов связи между нуклеотидами образуются по-разному. Как в клеточных РНК, так и в продуктах рибозимов-полимераз, фосфатные мостики всегда связывают третий углеродный атом одного остатка рибозы с пятым атомом другого (3' – 5' – фосфодиэфирная связь, см. рис. 9.1). Без ферментов же наравне с 3' – 5' связями образуются неправильные 2' – 5' связи, и долго было непонятно, насколько это мешает появлению активных рибозимов;
• неферментативное копирование требует высокой концентрации магния, что приводит к постепенному разрушению как РНК-матрицы, так и активированных нуклеотидов. Нуклеотиды теряют фосфатные группы и превращаются в нуклеозиды, которые сами непригодны для построения цепи РНК и, хуже того, конкурируют с нуклеотидами за место на копируемой цепи РНК;
• нуклеозиды надо как-то убирать из среды, где происходит копирование РНК, или превращать их обратно в нуклеотиды;
• химические способы реактивации нуклеозидов опасны для РНК-матрицы.
По последним данным, не все эти проблемы действительно серьезны. Оказалось, что случайное чередование 3' – 5' и 2' – 5' связей не нарушает активность рибозимов по сравнению с чистыми 3' – 5' связанными РНК (Engelhart et al., 2013). Более того, примесь 2' – 5' связей снижает устойчивость двунитевой РНК и облегчает ее расплетание для повторного копирования. Так как доля 2' – 5' связей в копиях одной РНК-молекулы будет отличаться, то между ними возможно своего рода разделение труда: молекулы с большей долей 2' – 5' связей будут служить матрицами для дальнейшего копирования, а с меньшей – будут более стабильными рибозимами. Иначе говоря, даже в пределах РНК-мира за счет изменчивости связей между нуклеотидами возможно некоторое разделение на генетический материал и функциональные молекулы.
Проблемы, связанные с побочными реакциями ионов магния, удалось решить в упомянутой выше работе Адамалы и Шостака. Адамала пробовала разные вещества, которые образуют устойчивые комплексы с ионами магния, в надежде, что эти комплексы будут участвовать в одних реакциях, подобно свободным ионам магния, но не смогут участвовать в других. И оказалось, что цитрат (лимонная кислота) образует комплекс с магнием с нужными свойствами. Магний-цитратный комплекс катализирует образование РНК из активированных нуклеотидов, но не катализирует гидролиз (разрушение) РНК и отдельных нуклеотидов. Кроме того, магний-цитратный комплекс безопасен для липидных оболочек протоклеток, в отличие от обычных магниевых солей. В этих экспериментах использовались мембраны из жирных кислот, по свойствам близкие к обычному мылу. Как известно, мыло в жесткой воде (содержащей много кальция и магния) плохо мылится, т. е. не образует пузырьков, и это долго было препятствием к репликации РНК в протоклетках.
Копирование РНК в тепловой ловушке
Все процессы соединения нуклеотидов в РНК очень чувствительны к концентрации нуклеотидов, которые в разбавленном растворе гораздо хуже соединяются в цепочки. К сожалению, все известные пути получения нуклеотидов, возможные в природных условиях, дают относительно разбавленные растворы продуктов. Было бы очень хорошо найти какой-нибудь эффективный механизм их концентрирования.
Как мы помним, возникновение жизни произошло на горячих источниках. В этом ландшафте возникают пересыхающие лужи, в которых могут накапливаться различные растворенные вещества, например формамид. К сожалению, для накопления нуклеотидов этот механизм не очень подходит: при испарении воды увеличивается концентрация всех растворенных веществ, включая минеральные соли, которых заведомо больше, чем нуклеотидов. Но, как оказалось, на тех же геотермальных полях есть механизмы концентрирования, которые отличают крупные молекулы нуклеотидов и РНК от растворенных минеральных солей. Для геотермальных полей характерны мелкопористые осадки и устойчивая разница температуры между горячей подземной водой и холодным воздухом. В этих условиях в порах и трещинах, заполненных водой, возникает устойчивая конвекция: поток жидкости и тепла. Благодаря конвекции и перепадам температур эти трещины становятся удобным местом концентрирования нуклеотидов и копирования РНК.
В работе Baaske et al. (2007) изучалось поведение нуклеотидов и РНК разной длины в поре, закрытой снизу и открытой сверху в холодную воду. При подогреве сбоку в такой поре происходят конвекция жидкости и перенос растворенных молекул вдоль градиента температуры (термофорез). Оказалось, что нуклеотиды и РНК в такой поре подсасываются из холодной воды и эффективно накапливаются в нижней части холодной стенки (рис. 9.4). Для поры шириной 1 мм и длиной 10 мм получается концентрирование нуклеотидов и коротких РНК в шесть-семь раз. Но степень концентрирования очень сильно (экспоненциально) зависит от отношения длины к ширине поры. Пора размером 0,1 мм × 10 мм или 1 мм × 100 мм концентрирует нуклеотиды примерно в 100 млн раз. РНК длиной примерно 40 нуклеотидов и более ведут себя по-другому по сравнению с одиночными нуклеотидами и короткими РНК. Они очень сильно концентрируются даже в коротких порах – в 20 000 раз в поре 1 мм × 10 мм для РНК длиной 100 нуклеотидов. Длинные молекулы РНК, попавшие в такую пору, практически неизбежно захватываются ею и накапливаются на маленьком (меньше 0,01 кв. мм) участке в нижней части холодной стенки. Концентрация РНК там ограничена только их физическими размерами.
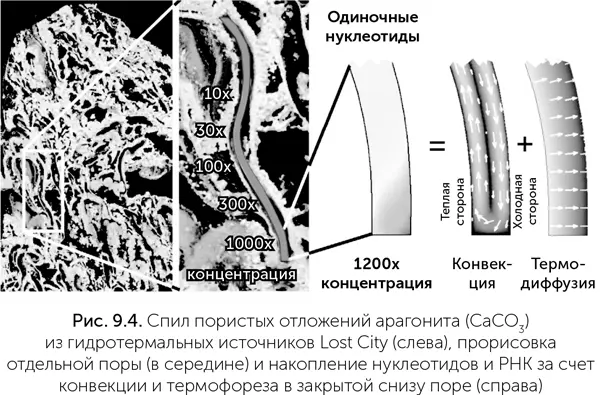
Если в такой закрытой нагреваемой поре происходит еще и образование РНК из нуклеотидов (здесь неважно, идет ли речь о копировании существующей РНК или о случайной сборке), то конвекция, термофорез и накопление нуклеотидов очень способствуют образованию длинных РНК. В работе Маста с коллегами (Mast et al., 2013) было рассчитано, что в тепловой ловушке будут получаться РНК длиной 200–300 нуклеотидов безо всяких ферментов и рибозимов. К сожалению, по техническим причинам проверяли они эти расчеты не на полимеризации РНК из отдельных нуклеотидов, а на ДНК, и при этом еще не сборка отдельных нуклеотидов, а стыковка 95-нуклеотидных фрагментов ДНК при помощи одноцепочечных «липких концов». Такие видоизменения потребовались потому, что только к фрагментам ДНК такой длины возможно присоединить флуоресцентные метки, не мешающие полимеризации. Но зато благодаря таким меткам удалось в реальном времени и с высоким разрешением измерить накопление и полимеризацию ДНК на нижнем конце холодной стенки. И в точном соответствии с теорией получилось, что молекулы ДНК в этих условиях получаются в 10–20 раз длиннее, чем при любой одинаковой со всех сторон температуре.
Читать дальшеИнтервал:
Закладка:







