Михаил Никитин - Происхождение жизни. От туманности до клетки
- Название:Происхождение жизни. От туманности до клетки
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2016
- Город:Москва
- ISBN:978-5-9614-4350-9
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Никитин - Происхождение жизни. От туманности до клетки краткое содержание
Происхождение жизни. От туманности до клетки - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
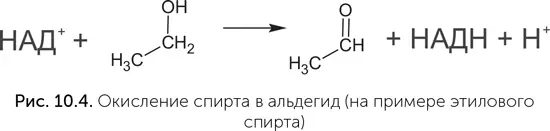
Кофермент А тоже прекрасно ладит с рибозимами. Очень впечатляет работа Вазанта Ядхава и Михаэля Яруса (Jadhav и Yarus, 2002). Они создали набор рибозимов, проводящих в одном опыте три последовательные химические реакции: пришивание КoA к концу РНК, активацию органической кислоты при помощи АТФ (при этом получается ацил-аденилат) и перенос кислотного остатка ацил-аденилата на КoA в составе рибозима. Затем другая команда химиков получила рибозим, который использует ацетил-КоА и малонил-КоА для реакции конденсации Клайзена (Ryu et al., 2006). В этой реакции – а она является ключевым шагом в построении длинных молекул жирных кислот – соединяются два остатка органических кислот.
Еще один кофермент, который удалось заставить работать вместе с рибозимом, – это тиаминпирофосфат, активная форма витамина В 1. Он используется в обмене веществ там, где надо присоединить или отщепить молекулу углекислого газа. Канадские химики Пол Чернак и Дипанкар Сен получили рибозим, который прочно связывает тиаминпирофосфат и с его помощью отщепляет СО 2от пировиноградной кислоты и ее аналогов (Cernak, Sen, 2013). Эта реакция очень важна в обмене веществ, через нее проходит «сгорание» всех потребляемых нами сахаров (подробнее в главе 11). Воспроизведение ее при помощи рибозима, а не белкового фермента – существенное доказательство возможности сложного обмена веществ до появления белков.
В той же лаборатории под руководством Дипанкара Сена рибозимы «подружились» и с гемом. Этот кофермент входит в состав гемоглобина крови, придавая ей красный цвет и способность переносить кислород. Кроме того, гем входит в состав цитохромов – большой группы белков, участвующих в самых разных окислительно-восстановительных реакциях.
РНК, отобранные на прочное связывание гема, заодно проводили две химические реакции: окисление разных веществ перекисью водорода при помощи гема и вставку цинка и меди в протопорфирин IX (подобная реакция происходит на последней стадии сборки гема) (Sen and Poon, 2011).
РНК и свет
Как мы помним, еще до возникновения жизни компоненты РНК прошли отбор на устойчивость к ультрафиолетовому излучению. Главный механизм этой устойчивости заключается в том, что азотистые основания очень быстро превращают энергию поглощенного ультрафиолета в тепло. Для запуска этого механизма поглощенная порция энергии должна быть достаточно велика. Азотистые основания поглощают ультрафиолет с длиной волны 240–280 нм (УФС), который сейчас задерживается озоновым слоем и не доходит до поверхности Земли. Более длинноволновый ультрафиолет (УФА и УФВ) азотистые основания не поглощают, и возбуждение соседних молекул, вызванное поглощением УФА или УФВ, не снимают. Следовательно, если мы хотим создать рибозим, который будет делать что-то полезное при помощи света, надо дать ему «антенну» – какую-то вспомогательную молекулу, чтобы она поглощала свет. И поглощать она должна видимый свет или УФА, чтобы азотистые основания не могли растратить его энергию в тепло. Примерно так рассуждали в лаборатории Дипанкара Сена, когда начали работу по созданию рибозима-фотолиазы.
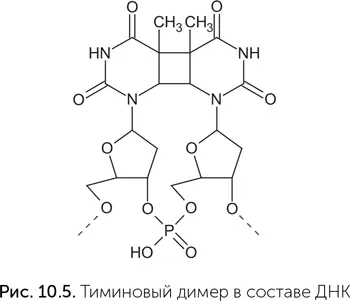
Обычная фотолиаза – это фермент, который чинит тиминовые димеры, один из типов повреждений ДНК, возникающих под воздействием ультрафиолета (рис. 10.5). Фотолиаза содержит кофермент ФАД и работает только при освещении синим светом. Для расщепления очень прочного четырехчленного кольца тиминового димера обычного восстановительного потенциала ФАД недостаточно, и в реакцию вступает его возбужденная синим светом форма (о возбужденных состояниях и их химических свойствах рассказывалось в главе 6).
Фотолиаза сохраняет некоторую активность и без ФАД. В этом случае ей нужен не синий свет, а ближний ультрафиолет (УФА), который поглощается аминокислотой триптофаном в составе белковой цепи. В норме триптофан передает возбуждение на ФАД, но без ФАД может и напрямую восстанавливать кольцо тиминового димера.
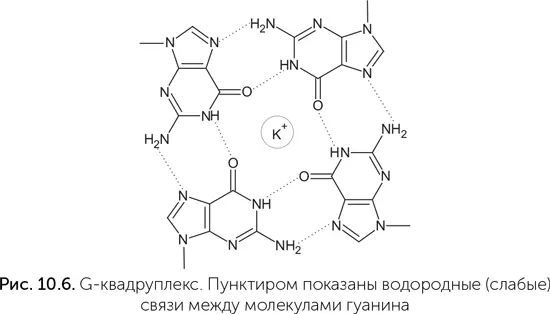
Аспиранты Дипанкара, зная эти детали, в эксперименте по отбору рибозимов-фотолиаз взяли в качестве антенны серотонин – производное триптофана. Серотонин работает в качестве сигнальной молекулы в нашей нервной системе, но ни в каких особых отношениях со светом замечен не был, хотя он хорошо поглощает УФА. В эксперименте было получено несколько разных рибозимов-фотолиаз, лишь немного уступающих по активности белку-фотолиазе. Подробное изучение показало, что один из этих рибозимов, названный UV1C, прекрасно обходится без серотонина (Chinnapen, Sen, 2004)! Он поглощает более коротковолновый ультрафиолет, чем рибозимы с серотонином (300 нм против 320), работает менее эффективно, но тоже неплохо. Как оказалось, за поглощение света и его использование в UV1C отвечает G-квардуплекс – особая структура из четырех гуанинов, связанных водородными связями в большое плоское кольцо (рис. 10.6). Такая структура взаимодействует со светом как единое целое. Квадруплекс поглощает более длинные волны, чем одиночный гуанин или пара G-C, и не рассеивает их в тепло. Такие четверки образуются в ДНК и РНК, богатых гуанином, и важны для поддержания устойчивости концевых частей хромосом в наших клетках. Они же, как оказалось, нужны для связывания гема рибозимами.
Та же фотолиаза вдохновила на исследования и Михаила Критского из Института биохимии имени А. Н. Баха в Москве. Его группа изучала взаимодействие со светом кофермента ФАД. Этот кофермент участвует во многих окислительно-восстановительных реакциях как переносчик водорода и электронов, но играет и другие роли. Кроме фотолиазы ФАД поглощает свет в криптохромах – белках, регулирующих суточные ритмы животных и растений. На основе ФАД-содержащих криптохромов у животных возникли также системы восприятия магнитного поля.
Критский с сотрудниками обнаружили, что флавин можно получить очень просто, запекая сухую смесь аминокислот (глутамат, глицин, лизин) при температуре 180 °C без доступа воздуха. При растворении запеченной смеси в воде с силикатами образуются микросферы из неупорядоченных пептидов, силикатов и флавина. Эти микросферы при освещении поглощают синий свет и за счет его энергии способны синтезировать АТФ из АДФ и неорганического фосфата, осуществляя фотореакцию с неплохой эффективностью – одна молекула АТФ на пять поглощенных квантов света (Kritsky et al., 2007). Реакция идет лучше в присутствии окислителей: воздуха, перекиси водорода или солей трехвалентного железа. Точный механизм флавиновых фотореакций неизвестен, но он включает какие-то промежуточные окислительно-восстановительные шаги. Силикатный матрикс микросфер, видимо, необходим для удержания реагирующих молекул в правильной ориентации друг к другу – просто раствор флавинов в воде не способен производить АТФ на свету (Telegina et al., 2013).
Читать дальшеИнтервал:
Закладка:







