Михаил Никитин - Происхождение жизни. От туманности до клетки
- Название:Происхождение жизни. От туманности до клетки
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2016
- Город:Москва
- ISBN:978-5-9614-4350-9
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Никитин - Происхождение жизни. От туманности до клетки краткое содержание
Происхождение жизни. От туманности до клетки - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Следующие по сложности использования ресурсы – отдельные азотистые основания и рибоза, образующиеся из цианида и формальдегида. Они должны быть правильно соединены друг с другом, чтобы получились нуклеозиды. Затем, когда и этот ресурс использован, можно было попытаться ускорить превращение гликольальдегида, глицеральдегида, формальдегида и цианистых соединений в нуклеотиды. Наконец, когда весь цианидно-формальдегидный дождь стал быстро и эффективно превращаться в РНК, в конкуренции начали выигрывать те химические системы (возможно, их уже допустимо называть живыми организмами), которые освоили восстановление углекислого газа и получили неисчерпаемый источник углерода.
Как только кончаются готовые активированные нуклеотиды – и строительный материал, и запас энергии «в одном флаконе», – нужно осваивать другие источники энергии. В условиях грязевых котлов их много. Например, летящие с вулканическими газами оксиды фосфора, растворяясь в воде, дают полифосфаты, которые легко использовать для активации нуклеотидов. Можно получать энергию, окисляя фосфиты и гипофосфиты, образующиеся из тех же вулканических оксидов фосфора. Можно как-то пристраиваться к фотохимическим реакциям на кристаллах сульфида цинка или пытаться улавливать солнечный свет своими силами. Мы не знаем, какие из этих источников энергии были освоены РНК-организмами раньше, но в итоге, скорее всего, они все так или иначе использовались.
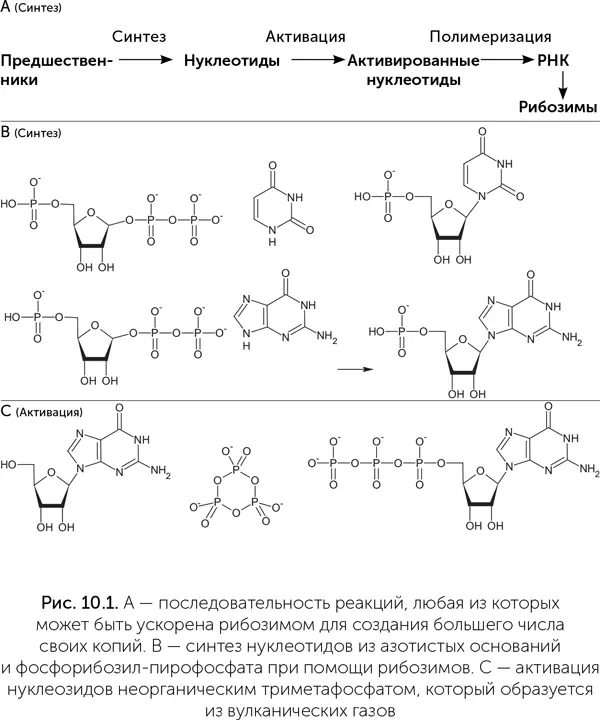
В лабораториях идет поиск рибозимов, которые проводили бы все эти реакции. Например, правильное соединение рибозы и азотистых оснований в нуклеозиды, которое так долго не удавалось сымитировать в абиогенных условиях, рибозимам вполне по силам. Путем искусственной эволюции были получены рибозимы, которые соединяют активированную форму рибозы (5-фосфорибозил-1-пирофосфат) с азотистыми основаниями, производя нуклеозиды. В клетках фосфорибозил-пирофосфат тоже является ключевым промежуточным продуктом на пути к нуклеозидам. Рибозим A15 соединяет с рибозой урацил и цитозин, а рибозим МА – аденин и гуанин (рис. 10.1). Оба они ускоряют соответствующую реакцию в миллионы раз (Martin et al., 2015).
Активация нуклеозидов путем добавления к ним трех фосфатных групп катализируется рибозимом TPR1 размером 96 нуклеотидов. В качестве источника фосфора и энергии он использует триметафосфат, промежуточный продукт растворения оксида фосфора в воде, который доступен в грязевых котлах. В водно-формамидном растворе фосфорилирование нуклеозидов может происходить даже без помощи рибозимов. Нужен только самый обычный фосфатный минерал гидроксилапатит Ca 5(PO 4) 3OH, немного солей меди и нагревание до 80 °C. Медь используется для фосфорилирования нуклеозидов и в современных клетках, она входит в состав фермента пурин-нуклеозид-киназы.
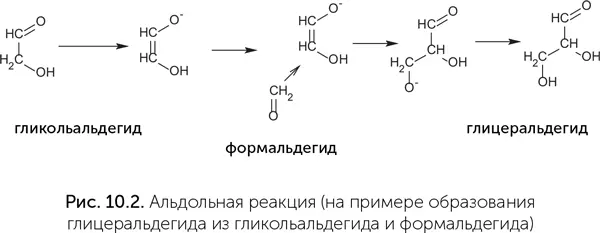
Основной шаг, повторяемый в реакции Бутлерова, называется в химии «альдольная реакция» (рис. 10.2). Рибозимы, проводящие альдольную реакцию, тоже получены в эксперименте (Chen et al., 2007). Для превращения в катализаторы им необходимы ионы цинка, подобно их функциональным белковым аналогам – альдолазам класса II.
Для многих других химических реакций, нужных для производства нуклеотидов из простых молекул, возможностей чистой РНК недостаточно. Прежде всего, РНК неспособна к окислительно-восстановительным реакциям, следовательно, рибозимы не могут восстанавливать СО 2и использовать энергию окисления неорганических веществ, таких как сера, железо и водород. Белки, состоящие из 20 разных аминокислот, могут проводить гораздо больше химических реакций, но и их возможности ограничены. Более половины ферментов для работы нуждаются в дополнительных веществах – коферментах и микроэлементах. Например, для проведения окислительно-восстановительных реакций в наборе из 20 аминокислот есть цистеин, который может легко и обратимо окисляться и восстанавливаться. Однако большинство ферментов окисления и восстановления нуждаются в дополнительных веществах. Это могут быть коферменты НАД (никотинамидадениндинуклеотид) и ФАД (флавинадениндинуклеотид), железосодержащий кофермент – гем, железосерные кластеры, молибденоптериновый комплекс и ряд более экзотических веществ.
РНК и витамины
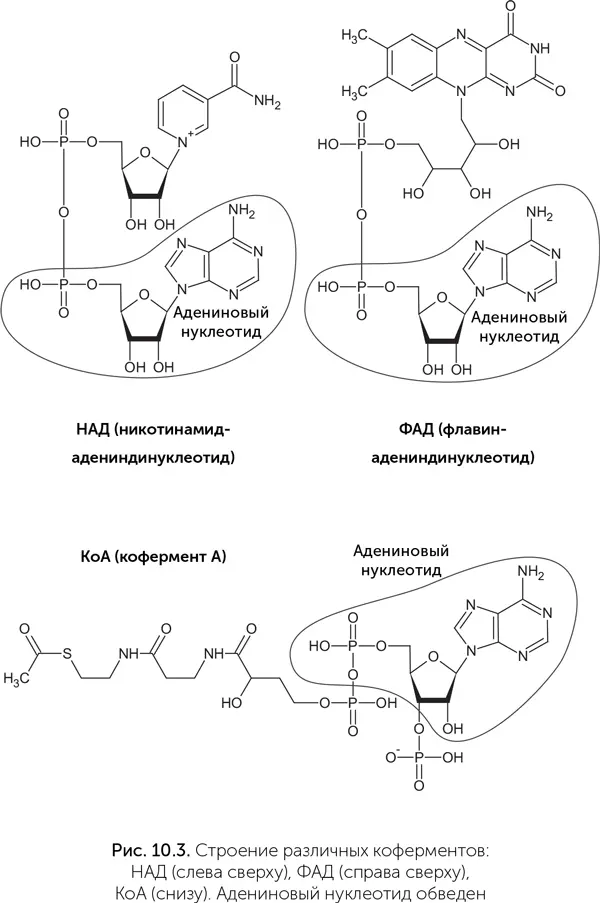
Коферменты – это разнородная группа веществ, которые выполняют особые функции в биохимии и не относятся ни к одному из основных классов веществ живых организмов (белки, нуклеиновые кислоты, сахара, липиды). Организм человека не способен производить большинство коферментов из простых предшественников, поэтому мы должны получать их «заготовки» с пищей, в виде витаминов. Коферменты НАД и ФАД переносят атомы водорода и участвуют в окислительно-восстановительных реакциях. Кофермент А (КoA) работает в реакциях, связанных с переносом ацетильных групп (-CO-CH 3) и других кислотных остатков. Тиаминпирофосфат принимает участие в реакциях карбоксилирования и декарбоксилирования (присоединения и отщепления углекислого газа). Цианкобаламин служит для переноса метильных (CH 3) групп.
Многие важнейшие коферменты имеют в своем составе адениновый нуклеотид: у кофермента А (КoA) к нему присоединена молекула витамина В 5, у НАД – витамин РР, у ФАД – витамин B 2(рис. 10.3). Адениновый нуклеотид также входит в состав аденозил-кобаламина – активной формы витамина В 12. Более того, у коферментов НАД и ФАД молекула в целом выглядит как два соединенных нуклеотида, где одно азотистое основание – обычный аденин, а в роли второго выступает никотинамид или флавин. Аденин в составе коферментов никак не участвует в их работе и служит только для узнавания коферментов белками. Скорее всего, это наследие РНК-мира, в котором витамины были пришиты к рибозимам для расширения их каталитических возможностей.
В опытах по искусственному отбору рибозимов были получены рибозимы, катализирующие часть этапов синтеза коферментов, а именно присоединение пантетеина, никотинамид-мононуклеотида и флавин-мононуклеотида к АТФ с образованием КoA, НАД и ФАД соответственно (Jadhav, Jarus, 2002). Также известны рибозимы, которые специфически пришивают НАД, ФАД или КoA к концу своей собственной молекулы или к другой РНК.
Коферменты НАД и ФАД переносят атомы водорода от одной молекулы к другой и необходимы в клетке для проведения окислительно-восстановительных реакций. Хотя в клетках они работают совместно с белками, в экспериментах были получены рибозимы, которые прочно и избирательно связывали НАД и с его помощью окисляли спирт в альдегид (рис. 10.4), – в клетках эту реакцию проводит НАД-содержащий белковый фермент алкоголь-дегидрогеназа (Tsukiji et al., 2004). Для никотинамида, ключевого компонента НАД, обнаружен простой путь синтеза, не требующий никаких ферментов и вполне реальный в условиях древней Земли. В нем простой сахар (диоксиацетон-фосфат) реагирует с аспарагиновой кислотой (одна из обычных аминокислот в составе белков) в водном растворе при температуре 60–100 °C (Cleaves, Miller, 2001). РНК, в которых на 5' конце находится НАД вместо обычного нуклеотида, обнаружены и в современных клетках: у кишечной палочки такой модификации подвергается до 15 % малых регуляторных РНК (sRNA) (Cahova et al., 2014), хотя функция НАД в составе этих РНК пока неизвестна.
Читать дальшеИнтервал:
Закладка:







