Е. Бессолицына - Биохимия метаболизма. Учебное пособие
- Название:Биохимия метаболизма. Учебное пособие
- Автор:
- Жанр:
- Издательство:Литагент Ридеро
- Год:неизвестен
- ISBN:9785448336638
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Е. Бессолицына - Биохимия метаболизма. Учебное пособие краткое содержание
Биохимия метаболизма. Учебное пособие - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Глиоксилатный цикл – одна из модификаций цикла лимонной кислоты
У растений и некоторых микроорганизмов, например у Е. coli, ацетильные группы часто служат не только высокоэнергетическим «топливом», но и источником метаболитов, из которых строятся углеродные скелеты углеводов. В таких клетках действуют два варианта цикла лимонной кислоты: 1) обычная последовательность реакций, в ходе которой происходит окисление ацетил-СоА до СО 2свойственная большинству тканей, и 2) особая ее модификация, называемая глиоксилатным циклом(последовательность реакций глиоксилатного цикла представлена на рисунке 9).
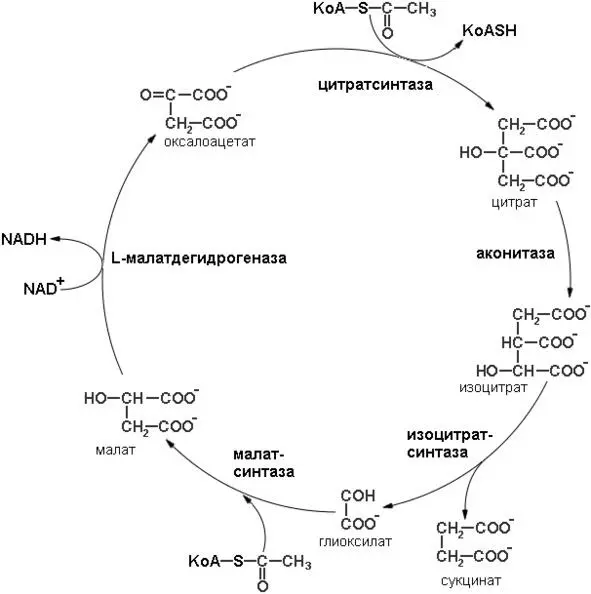
Рисунок 9: Схема реакций глиоксилатного цикла
В глиоксилатном цикле ацетил-СоА взаимодействует с оксалоацетатом, в результате чего образуется цитрат. Однако расщепление изоцитрата происходит не в обычной изоцитратдегидроненазной реакции, как в цикле лимонной кислоты, а особым путем под действием фермента изоцитратлиазыс образованием сукцината и глиоксилата. Образовавшийся глиоксилат далее конденсируется с другой молекулой ацетил-СоА, что приводит к образованию малата, эта реакция катализируется малатсинтазой.Затем малат окисляется до оксалоацетата, который может конденсироваться с новой молекулой ацетил-СоА, начиная тем самым новый оборот цикла.
При каждом обороте глиоксилатного цикла в него вступают две молекулы ацетил-СоА и образуется одна молекула сукцината, которая затем используется в процессах биосинтеза. Сукцинат может превращаться через фумарат и малат в оксалоацетат из которого образуется фосфоенолпируват путем обращения описанной выше фосфоенолпируваткарбоксикиназной реакции. Фосфоенолпируват используется в качестве предшественника при биосинтезе глюкозы.
У животных глиоксилатный цикл отсутствует; изоцитратсинтазы и малатлиазы в животных клетках нет. В организме животных существуют другие пути для синтеза углеводов из простых предшественников.
В прорастающих семенах глиоксилатный цикл, напротив, функционирует очень активно: таким путем из ацетильных групп (источником которых служат жирные кислоты, входящие в состав запасных триацилглицеролов) образуется глюкоза. Ферменты изоцитратлиаза и малатсинтаза находятся в растительных клетках в особых цитоплазматических органеллах глиоксисомах.
Дыхательная цепь и окислительное фосфорилирование
Как было рассмотрено ранее, суммарная реакция окисления глюкозы до CO 2в реакциях гликолиза и цикле трикарбоновых кислот выглядит следующим образом:
Глюкоза +10NAD ++2FAD ++2АДФ+2 ГДФ = 6 CO 2 +10NADH +2FADH 2+2ГТФ +2ATФ
Как видно из суммарной реакции энергетический выход данного процесса окисления невелик: 2 АТФ из гликолиза и 2 ГТФ из цикла трикарбоновых кислот, если цикл идет в печени, то есть только в печеночной ткани цикл трикарбоновых кислот дает энергетический выход в виде нуклеозидтрифосфатов. При этом основным продуктом окисления являются восстановленные доноры/акцепторы электронов или NADH и FADH 2, поэтому важным фактором является доказательство возможности использовать данные молекулы в качестве источника энергии. Хотя в составе данных молекул присутствуют фосфоангидридные связи, характерные для нуклеозидтрифосфатов, и, следовательно, данные молекулы могут быть донорами энергии как АТФ, но гидролиз данных молекул не является экономически выгодным, так как затраты на синтез этих молекул слишком велик.
Вторая проблема связана с тем, что гидролиз связи может происходить как в окисленной, так и в восстановленной молекуле, следовательно, с такой точки зрения цикл трикарбоновых кислот становится бессмысленным, что для природы не характерно.
Из этого можно сделать вывод, что запасание энергии связано с процессом восстановления окислительно-восстановительных эквивалентов NAD +и FAD +и окислительно-восстановительными реакциями.
Основным параметром в окислительно-восстановительных реакциях является их способность отдавать (быть восстановителем) или принимать (быть окислителем) электроны в ходе реакции. Экспериментальной характеристикой этих способностей молекул является окислительно-восстановительный потенциал или red/ox потенциал.
Окислительно-восстановительные потенциалы и изменения свободной энергии
Окислительно-восстановительный потенциал – это электрохимическая категория. Необходимо рассмотреть для примера вещество, которое может существовать в окисленной X +и в восстановленной форме Х. Такая пара называется окислительно-восстановительной парой (схема эксперимента для определения окислительно-восстановительного потенциала представлена на рисунке 10).

Рисунок 10: Структура эксперимента метода полукамер для определения окислительно-восстановительного потенциала
Окислительно-восстановительный потенциал такой пары можно определить, измеряя электродвижущую силу, развиваемую опытной полукамерой по отношению к стандартной контрольной полукамере. Опытная полукамера представляет собою электрод, погруженный в раствор 1 М окислителя (X +) и 1 М восстановителя (X). Стандартная контрольная полукамера состоит из электрода, погруженного в 1 М раствор Н +, находящийся в равновесии с газообразным Н 2при давлении в 1 атм. Электроды присоединяют к вольтметру и агаровым мостиком обеспечивают электропроводность между полукамерами. Происходит поток электронов oт одной полукамеры к другой. Если реакция идет в направлении
X + H +→ X ++1/2H 2.
то в полукамерах будут происходить следующие реакции:
Х → X ++ ē, H ++ ē → 1/2H 2
Таким образом, электроны движутся от опытной полукамеры к контрольной и, следовательно, электрод в опытной полукамере заряжен отрицательно по отношению к электроду стандартной полукамеры. Окислительно-восстановительный потенциал пары X +:X соответствует напряжению в начале эксперимента (когда концентрации X +, X и Н +равны 1 М). Окислительно-восстановительный потенциал пары Н +:Н 2определен равным 0 В (вольт).
Значение окислительно-восстановительного потенциала теперь очевидно. Отрицательный окислительно-восстановительный потенциал говорит о том, что данное вещество имеет меньшее сродство к электронам, чем Н 2(как в вышеприведенном примере), то есть молекула является донором электронов, то есть восстановителем. Положительный окислительно-восстановительный потенциал свидетельствует о более высоком, чем у Н 2, сродстве данного вещества к электронам, то есть является окислителем или молекулой, с большей легкостью присоединяющей электроны. Эти соотношения относятся к стандартным условиям, когда концентрации окислителя, восстановителя и Н +равны 1 М и давление Н 2составляет 1 атм.
Читать дальшеИнтервал:
Закладка:










