Е. Бессолицына - Биохимия метаболизма. Учебное пособие
- Название:Биохимия метаболизма. Учебное пособие
- Автор:
- Жанр:
- Издательство:Литагент Ридеро
- Год:неизвестен
- ISBN:9785448336638
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Е. Бессолицына - Биохимия метаболизма. Учебное пособие краткое содержание
Биохимия метаболизма. Учебное пособие - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Таким образом, сильный восстановитель (например, NADH) обладает отрицательным окислительно-восстановительным потенциалом, тогда как сильный окислитель (О 2) имеет положительный окислительно-восстановительный потенциал. Окислительно-восстановительные потенциалы многих биологически важных окислительно-восстановительных пар известны.
Изменение свободной энергии окислительно-восстановительной реакции можно легко вычислить из разности окислительно-восстановительных потенциалов реагирующих соединений.
Любую окислительно-восстановительную реакцию в общем виде можно представить следующим образом:
Сначала нужно ввести обозначения: окислитель + – окисленная форма окислителя, окислитель – восстановленная форма окислителя, восстановитель – восстановленная форма восстановителя, восстановитель + – окисленная форма восстановителя. Запишем общую реакцию, испльзуя обозначения:
окислитель ++ восстановитель → окислитель +восстановитель +(реакция А)
Любую окислительно-восстановительную реакцию разделяют на две полу-реакции, каждая из которых представляет собой обмен электронами между окисленной и восстановленной формами окислительно восстановительной пары, чей потенциал можно измерить в эксперименте, описанном выше:
окислитель ++ ē → окислитель (реакция Б)
Окислительно восстановительный потенциал этой пары Е 1 восстановитель ++ ē→ восстановитель (реакция В)
Окислительно восстановительный потенциал этой пары Е 2
Вычитая реакцию в) из реакции б), получаем желаемую реакцию а) и ΔE» о
Теперь можем рассчитать ΔG 0» для восстановления пирувата за счет NADH. Изменение стандартной свободной энергии ΔG 0» связано с изменением окислительно-восстановительного потенциала ΔE' о уравнением
ΔG 0= -nF ΔE» о
где n- число переносимых электронов, F-число Фарадея (23,062 ккал • В -1 • моль -1), ΔE' о выражается в вольтах, ΔG 0в килокалориях на моль.
Величина окислительно-восстановительного потенциала дыхательной цепи составляет 1,14 В, что соответствует 53 ккал.
Изменение окислительно-восстановительного потенциала при переходе от системы NAD +/NADH к системе О 2/Н 2О составляет 1,1 В.
Движущая сила окислительного фосфорилирования – это потенциал переноса электронов, присущий NADH или FADH 2. Рассчеты ΔE' о и ΔG 0связанные с окислением NADH под действием О 2. Промежуточные частичные реакции следующие:
а) 1/2О 2+2Н ++2 ē→ Н 2О
E« о = +0,82 В,
б) NAD ++ Н ++2 ē→ NADH
E« о = – 0,32 В.
Вычитая реакцию б) из реакции а), получаем
в) 1/2 О 2+ NADH + Н +→ Н 2О + NAD +
ΔE' о = +1,14 В.
Свободная энергия окисления для этой реакции составляет
ΔG 0= -2—23,062.1,14 = – 52,6 ккал/моль.
Таким образом доказано, что молекула NADH является источником энергии, и, как показывают расчеты, при окислении этой молекулы с участием кислорода выделяется такое количество энергии, которое достаточно для синтеза 7 молекул АТФ. Но реакция происходит взрывообразно, и это не позволяет перевести энергию в более адекватную форму.
Чтобы обеспечить перевод энергии окисления в энергию АТФ необходима система окисления, это обеспечивает дыхательная цепь, состоящая из 4-х белковых комплексов, содержащих коферменты, участвующие в окислительно-восстановительных реакциях. В результате мы имеем с одной стороны материальную группу молекул, передающих электроны друг от друга, то есть образуется система передачи электронов от NADH к О 2по которому идут электроны, как электрическая цепь в сети, с другой стороны это последовательность окислительно-восстановительных реакций, которые происходят в составе электронтранспортной цепи, молекулы коферментов являются окислителями (акцепторами электронов) при взаимодействии с предшествующими молекулами, и являются восстановителями (донорами электронов) при взаимодействии со следующей молекулой цепи.
Из этого заключаем, что каждый следующий кофермент является большим окислителем, чем предыдущий, то есть этот кофермент «отбирает» электроны у предыдущего кофермента, а у него электроны «отбирает» следующий кофермент в электронтранспортной цепи. В данном случае наблюдается увеличение окислительно-восстановительного потенциала, следовательно, каждый следующий кофермент в электронтранспортной цепи является большим окислителем, и, как следствие, электронтранспортная цепь не только физическая часть для потока электронов, но и последовательность окислительно-восстановительных реакций.
Организация электронтранспортной цепи
Электронтранспортная цепь организована во внутренней мембране митохондрий и представляет собой четыре белковых комплекса, содержащих коферменты, окислительно-восстановительных реакций (общий план организации и функционирования электрон-транспортной цепи изображен на рисунке 11).
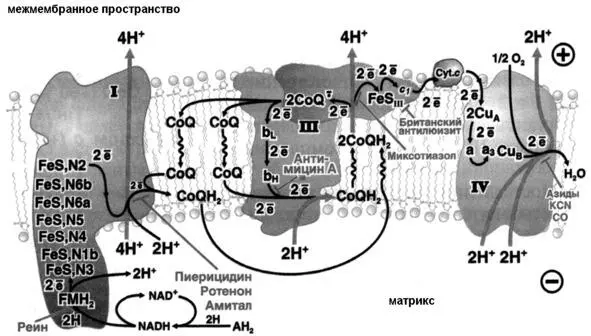
Рисунок 11: Схема общей организации дыхательной цепи (источник: Скулачев В. П., Богачев А. В., Каспаринский Ф. О. Мембранная биоэнергетика М.: Издательство МГУ, 2012)
Первый комплекс – NADH-дегидрогеназа (комплекс I), сукцинат-дегидрогеназа (комплекс II), убихинон-цитохром с редуктаза (комплекс III), цитохром оксидаза (комплекс IV).
NADH-дегидрогеназа (комплекс I) включает в себя флавинмононуклеотид (FMH) и как минимум шесть Fe-S комплексов. Известны три вида Fe-S-центров. В простейшем случае единственный атом железа тетраэдрически координирован с сульфогидрильными группами четырех цистеиновых остатков белка. Второй вид комплексов (обозначен как Fe 2-S 2) содержит 2 атома железа и два неорганических дисульфида, присоединенных к четырем цистеиновым остаткам. В комплексах третьего вида (Fe 4-S 4) содержится четыре атома железа, четыре неорганических сульфида и четыре остатка цистеина. В состав NADH-дегидрогеназы входят два кофермента класса Fe 2-S 2, и четыре класса Fe 4-S 4(Схема организации и функционирования коферментов комплекса I представлена на рисунке 12).
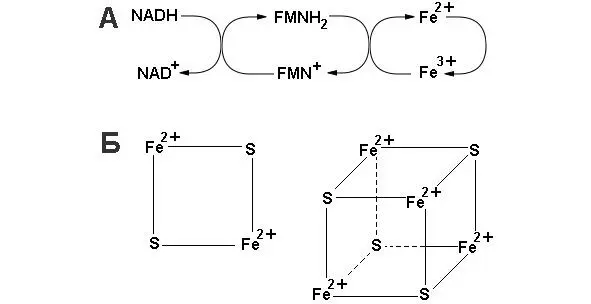
Рисунок 12: А – схема окислительно-восстановительных реакций в комплексе I; Б – структура FeS коферментов
Сукцинат-дегидрогеназа (комплекс II) состоит из 4 субъединиц с молекулярными массами 70, 30, 14 и 12 кDa и содержит в качестве окислительно-восстановительных групп флавинадениндинуклеотид (FAD), ковалентно связанный с самой тяжелой субъединицей, и 3 Fe-S-кластера (один Fe 2-S 2и два Fe 4-S 4), ассоциированных с субъединицей с молелекулярной массой 30 кDa.
Комплекс I обеспечивает окисление молекулы NADH, а комплекс II окисляет молекулу FADH 2, электроны поступают на коферменты электрон-транспортной цепи и в конце концов поступают на молекулу убихинона или кофермента Q. Кофермент Q – хиноновое производное с длинным изопреноидным хвостом. Его называют также убихиноном из-за его повсеместного распространения в биологических системах.
Читать дальшеИнтервал:
Закладка:










