Е. Бессолицына - Биохимия метаболизма. Учебное пособие
- Название:Биохимия метаболизма. Учебное пособие
- Автор:
- Жанр:
- Издательство:Литагент Ридеро
- Год:неизвестен
- ISBN:9785448336638
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Е. Бессолицына - Биохимия метаболизма. Учебное пособие краткое содержание
Биохимия метаболизма. Учебное пособие - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Число изопреновых единиц в коферменте Q зависит от вида живых организмов, У млекопитающих его наиболее распространенная форма содержит десять изопреновых единиц и обозначается как Q 10. Изопреноидный хвост обуславливает высокую неполярность Q, которая способствует его быстрой диффузии в углеводородной фазе внутренней митохондриальной мембраны. Кофермент Q является компонентом митохондриальных липидов; среди других липидов преобладают фосфолипиды, являющиеся частью митохондриальной мембраны. Структура кофермента Q сходна со структурой витаминов К и Е.
Близкую структуру имеет и пластохинон, находящийся в хлоропластах. Все эти вещества имеют в своей структуре полиизопреноидную боковую цепь. Содержание кофермента Q значительно превосходит содержание других компонентов дыхательной цепи (по параметру стехиометрии); это позволяет предположить, что кофермент Q является подвижным компонентом дыхательной цепи, который получает восстановительные эквиваленты от фиксированных флавопротеиновых комплексов и передает их на цитохромы. Кофермент Q-единственный переносчик электронов в дыхательной цепи, который не связан прочно с белком и не присоединен к нему ковалентно. Кофермент Q действительно служит высокомобильным переносчиком электронов между флавопротеинами и цитохромами цепи переноса электронов.
Убихинон-цитохром с редуктаза (комплекс III) включает 11 субъединиц с молекулярным весом: 49,5, 47, 44, 28, 21,5, 13,5, 9,5, 9, 8, 7, 6,5 kDa соответственно. Третья субъединица весом 44 kDa присоединяет две молекулы гемов b H и b L . Центральную роль цитохромов в дыхании открыл в 1925 г. Дэвид Кейлин (David Keilin).
Цитохром – это переносящий электроны белок, молекула которого содержит в качестве простетической группы гем.
Гем – это модифицированная молекула тетрапиррольного кольца, в центре которой ассоцииирован ион металла (это могут быть ионы железа, меди и других металлов). В зависимости от радикалов, модифицирующих кольцо, и от ионов ассоцированных с кольцом гема, выделяют несколько классов цитохромов. Субъединица V или белок Риске содержит Fe 2-S 2кластер. Субъединица VI связывает убихинон, субъединица IV координирует цитохром с. Функции остальных субъединиц не выявлены или участвуют в организации комплекса (схема функционирования убихинона и коферментов комплекса III представлена на рисунке 13).
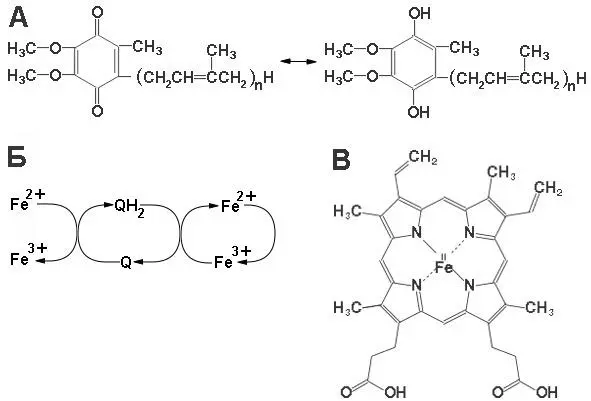
Рисунок 13: А – схема окислительно-восстановительной реакции с убихиноном; Б – схема окислетельно-восстановительных реакций между FeS белком и убихиноном, между убихиноном и гемом; В – структура гема в цитохромах
Электроны с убихинон-цитохром с редуктазы переносятся на цитохром с. Цитохром с – водорастворимый, подвижный белок с молекулярной массой 12 kDa. Этот белок мигрирует между комплексами III и IV в межмембранном пространстве.
Цитохром оксидаза (комплекс IV) содержит восемь белковых субъединиц, с ними ассоциированы два гема, содержащих ионы меди, которые называют гемы а и а3. Кроме этого содержит два иона меди Cu Aи Сu B. Центр Сu Bпредставляет ион меди соединенный с радикалами трех остатков гистидина. Центр Cu Aсодержит два атома меди расположенных очень близко и скоординированных с белком (схема функционирования коферментов комплекса IV представлена на рисунке 14).
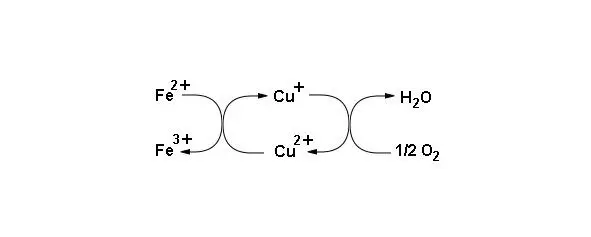
Рисунок 14: Схема функционирования коферментов комплекса IV
Механизмы переноса электронов в электронтранспортной цепи
Первый комплекс или NADH-дегидрогеназа взаимодействует с молекулой NADH, электроны переносятся на (FMN), в результате FMN принимает с NADH два электрона и два протона от среды, и образуется NAD+ и FMNH 2, затем электроны переносятся на первый комплекс Fe 4-S 4белка в результате происходит окисление FMNH 2и перенос электронов на ион железа Fe-S белка, далее железо в комплексе восстанавливается из положения Fe 3+до Fe 2+. Это происходит потому, что окислительно-восстановительный потенциал NADH меньше, чем у FMN, поэтому происходит окисление NADH флавинмононуклеотидом, который затем окисляется Fe 4-S 4 белком, чей окислительно-восстановительный потенциал еще больше. Далее происходит серия окислительно-восстановительных реакций с участием Fe-S белков, каждый из которых является большим окислителем, чем предыдущий.
В результате восстановленный ион железа Fe 2+Fe-S белка предшественника, окисляется до положения Fe 3+, следующим цепи транспорта электронов Fe-S белком, чей окислительно-восстановительный потенциал выше, чем у предшественника, в результате ион железа окислителя восстанавливается из положения Fe 3+с Fe 2+.
Особенностью флавинмононуклеотида является способность переносить два электрона, как и другие нуклеотидсодержащие коферменты, тогда как железо-серные белки переносят только по одному электрону, именно поэтому флавинмононуклеотид является адаптором процесса электронов с NADH на Fe-S белки.
Затем происходит последовательный перенос с одного Fe-S белка на другой, где один ион железа окисляется, а второй восстанавливается. Точно также ион железа Fe-S белка восстановителя окисляется из Fe 2+в Fe 3+, а в белке окислителе восстанавливается из Fe 3+в Fe 2+. Конечным акцептором является Fe 4-S 4белок, чья восстановленная Fe 2+форма, окисляется до Fe 3+убихиноном, который обладает большим окислительно-восстановительным потенциалом. В результате окисленная форма хинона Q переходит в восстановленную QH 2.
Вторым источником электронов для убихинона является сукцинатдегидрогеназа: фермент цикла трикарбоновых кислот. Два электрона переносятся с сукцината на FAD в цикле трикарбоновых кислот. В результате FAD восстанавливается до FADH 2, который окисляется Fe-S-белками, каждый из которых является большим окислителем и точно также происходит перенос электронов на ион железа в Fe-S-белках, а в конце концов на убихинон, который в результате восстанавливается до QH 2.
Восстановленный убихинон (QH 2) диффундирует к комплексу III, где связывается с субъединицей QIII, где происходит окисление восстановленного убихинона, протоны высвобождаются в межмембранное пространство, а электроны поступают на электронтранспортную цепь.
Один электрон поступает на на ген b L , а затем гем b H , а потом на хинон для дальнейшего восстановления за счет работы комплекса I или комплекса II. А вот второй электрон поступает на Fe-S белок, в результате происходит восстановление иона железа из Fe 3+до Fe 2+, так как этот комплекс более сильный окислитель. Далее Fe-S белок окисляется цитохромом с 1 , содержащим в составе гема ион железа. В ходе реакции ион железа в Fe-S белке окисляется от Fe 2+в Fe 3+, а в цитохроме с 1ион железа восстанавливается Fe 3+до Fe 2+. Затем цитохром с 1 окисляется подвижным цитохромом с , также содержащим ион железа, который восстанавливается до положения Fe 2+.
Читать дальшеИнтервал:
Закладка:










