Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Название:Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1980
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи краткое содержание
Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
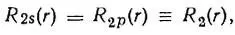
то гибридные АО имели бы вид
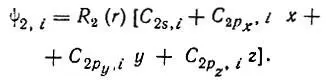 (3.46)
(3.46)
Именно такое представление гибридных АО и было дано Полингом (только в иных обозначениях). В действительности же радиальные атомные функции для разных значений квантового числа l различаются. Однако это обстоятельство не могло быть учтено в 30-х годах, хотя бы потому, что аналитические АО многоэлектронных атомов еще не были вычислены. Форму гибридной орбитали, точнее ее угловую зависимость, можно характеризовать полярной диаграммой:
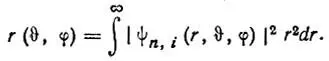 (3.47)
(3.47)
Эта диаграмма может быть построена независимо от того, совпадают или нет радиальные функции, входящие в атомные орбитали. На рис. 18 приведены примеры этих диаграмм.
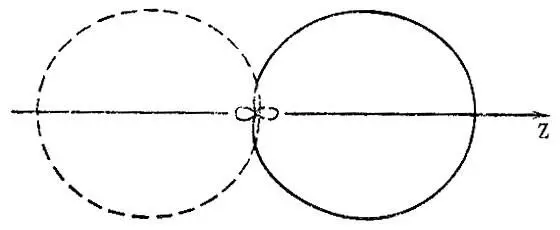
Рис. 18. Полярные диаграммы для spsub0/sub-гибридных АО углерода (одна из двух эквивалентных гибридных АО изображена сплошной линией, вторая — штриховой)
Теория гибридизации интенсивно обсуждается в современной литературе [22, 63, 73, 74, 88, 89], поэтому интерес к ней выходит за чисто исторические рамки. В связи с этим остановимся здесь на некоторых вопросах, связанных с попытками расширить первоначальную концепцию Полинга.
Вид гибридных орбиталей (т. е. коэффициенты гибридизации) при достаточно высокой симметрии окружения рассматриваемого атома может определяться из условий ортонормированности и эквивалентности гибридных орбиталей, как и в данном примере молекулы метана. В общем же случае необходимо привлечение дополнительных принципов, количественно определяющих коэффициенты гибридизации, таких, как, например, принцип максимального перекрывания. Согласно этому принципу, химическую связь образует пара сильно перекрывающихся гибридных атомных орбиталей, относящихся к соседним "непосредственно связанным" атомам в молекуле. Неподеленные электронные пары или вакантные орбитали описываются гибридными орбиталями либо неперекрывающимися, либо слабо перекрывающимися со всеми остальными АО как рассматриваемого, так и всех прочих атомов молекулы. Кроме того, по интегралам перекрывания для двух гибридных АО, обеспечивающих химическую связь атомов, можно судить о прочности этой связи, причем предполагается, что при отсутствии перекрывания атомных орбиталей образование химической связи невозможно.
При использовании принципа максимального перекрывания в его обобщенной формулировке, данной Малликеном в 1950 г., следует преобразовать орбитали каждого атома так, чтобы они, оставаясь ортогональными друг к другу, максимально (или минимально) перекрывались с АО других атомов, образующих молекулу [17] При этом Малликен учитывал (в отличие от Полинга) не только угловые, но и радиальные функции АО.
. Используя аналитические шестиэкспоненциальные функции Клементи, мы провели для примера расчеты гибридных орбиталей в молекулах NН 3, Н 2O и др. Для гидридов АН n(n < 4) орбитали атома А могут быть унитарно преобразованы таким образом, что выделяются отдельные гибридные АО, строго ортогональные ко всем остальным орбиталям атомов молекулы. Например, для молекулы аммиака полносимметричная гибридная АО азота
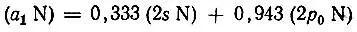 (3.48)
(3.48)
ортогональна не только к другим орбиталям атома азота, но и к 1s-АО водорода. Аналогично для молекулы воды гибридная орбиталь кислорода
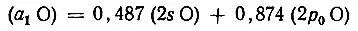 (3.49)
(3.49)
и 2py-АО также ортогональны ко всем прочим АО в молекуле. Очевидно, что приведенные гибридные орбитали согласно принципу максимального перекрывания должны описывать неподеленные электронные пары атомов N и О.
Эти результаты свидетельствуют о том, что принцип максимального перекрывания приводит к явно завышенному вкладу s-орбиталей в гибридные АО неподеленных пар. Соответственно завышенным оказывается вклад s-AO в образование химической связи [18] То, что неподеленные пары должны иметь преимущественно s-характер, следует как из химических соображений, основанных на сопоставлении орбитальных энергий 2s и 2р-АО (E 2s = 25,6 эВ, E 2р = 13,2 эВ для атома азота и E 2s = 33,7 эВ, E 2р = 15,9 эВ для атома кислорода), так и из квантовохимических расчетов последних лет, выполненных в формализме матрицы плотности.
.
Теперь вернемся к работам Полинга. Следует отметить, что сам он не следовал строго принципу максимального перекрывания. Фактически Полинг использовал другой критерий, а именно требование ориентации гибридных АО по линии связи, и оперировал при этом исключительно с угловыми функциями, полагая, что радиальные компоненты 2s- и 2р-АО тождественны. Существенным (и, можно сказать, парадоксальным) было то, что такой подход, называемый часто "теорией направленных валентностей" (термин Полинга), давал результаты более разумные, чем те, которые можно было получить, строго следуя принципу максимального перекрывания. Поэтому вряд ли можно утверждать, что последний, учитывающий наряду с угловой также и радиальную зависимость АО, явился развитием теории направленных валентностей.
Не очень ясен вопрос и о другом ограничении ранней концепции гибридизации, суть которого состоит в том, что под преобразованием АО понимались не все унитарные преобразования, затрагивающие орбитали как с одинаковыми, так и с различными квантовыми числами момента импульса, а лишь ортогональные (т. е. вещественные) преобразования вещественных АО, в результате чего получались вещественные гибридные функции. Последние же не могут образовывать между направлениями своей ориентации угол меньше 90°.Это ограничение особенно сильно сказалось в органической квантовой химии, так как вынуждало химиков использовать старую идею Байера о напряженных химических связях, что приводило к многочисленным искусственным построениям, подробно рассмотренным в монографии Г. В. Быкова [5]. В 1967-1969 гг. Мартенссоном была выдвинута теория комплексной гибридизации [68], по которой углы между гибридными АО могут быть и меньше 90°.
Однако получаемые при этом волновые функции системы являются комплексными и не могут быть преобразованы в вещественные, хотя гамильтониан задачи не содержит членов, отвечающих магнитным взаимодействиям. Таким образом, вопрос о том, что же является развитием концепции Полинга — теория Мартенссона или модифицированная идея Байера, остается открытым.
Читать дальшеИнтервал:
Закладка:









