Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Название:Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1980
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи краткое содержание
Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
В силу нечетности оператора возмущения отличными от нуля будут лишь недиагональные матричные элементы с совпадающими значениями квантовых чисел m и m'. В частности, для n = 2, соответственно двукратному вырождению по l = 0 и 1, получается секулярное уравнение второго порядка
 (3.42)
(3.42)
где 
Правильные функции нулевого приближения
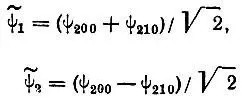 (3.43)
(3.43)
являются в этом случае эквивалентными гибридными атомными орбиталями (sp 0— гибридизация) атома водорода в однородном электрическом поле. Обе функции, ψ 1и ψ 2, соответствуют нулевой проекции орбитального момента импульса на направление внешнего поля, т. е. являются орбиталями σ-типа. Дважды вырожденные орбитали π-типа ψ 21,+1и ψ 21,-1в аксиальном электрическом поле остаются негибридизованными, и их энергетические уровни не изменяются.
Все сказанное выше справедливо для возбужденных состояний атома водорода с присущим ему специфическим вырождением. Для прочих атомов энергетические уровни зависят как от n, так и от l. Однако и в этом случае также можно было ожидать эффективное смешение атомных орбиталей одного слоя (т. е, орбиталей с одинаковыми n, но разными l), если расстояние между уровнями Е nlи Е nl'достаточно мало по сравнению с энергией возмущения. Такая ситуация, по мнению Полинга, должна реализоваться в молекулах, где атомы находятся в сильном электрическом поле, создаваемом ядрами и электронами других атомов молекулы. Анизотропия этого поля приводит к тому, что орбитальный момент импульса электрона не сохраняется и квантовое число l теряет смысл, поэтому возможно смешение атомных орбиталей как с одинаковыми, так и с различными значениями l. В то же время возможность гибридизации функций разных слоев представляла ь Полингу сомнительной ввиду большой разности в соответствующих энергиях. Исключение могут представлять атомы перех дных элементов, в которых энергии (n — 1) d-AO сопоставимы энергиями ns- и nр-АО.
Следует отметить, однако, что более глубокий анализ проблемы обнаруживает существенное несоответствие между традиционным — назовем его условно "химическим" — представлением о гибридизации, ве ущим свое начало от работ Полинга 1928 и 1931 гг. [71-72], и тем — назовем его условно "физическим" — представлением, к которому приводят изложенные выше рассуждения, натолкнувшие Полинга на идею гибридизации. Так, для молекулы метана, согласно химическим представлениям, атомные орбитали углерода должны быть гибридизованы в четыре (гибридных) АО h i, ориентированных к атомам водорода и обеспечивающих представление локализованных на связях C-H iдвухцентровых МО в виде
 (3.44)
(3.44)
Преобразования тетраэдрической группы симметрии переводят гибридные АО h iдруг в друга. Эти орбитали были названы поэтому Леннард-Джонсом (1949 г.) "эквивалентными" относительно точечной группы симметрии молекулы (T d). В тоже время правильные функции нулевого приближения должны классифицироваться по неприводимым представлениям (НП) этой группы. Такими трансформационными свойствами обладают негибридные2s-, 2р-орбитали атома углерода. При этом 2s-АО преобразуются по полносимметричному,а трехкратно вырожденные 2р-АО-по трехмерному НП группы T d. Таким образом, анализ концепции гибридизации, основанный на эффекте Штарка, приводит к весьма своеобразной ее формулировке, при которой атомные орбитали углерода в молекуле СH 4оказываются негибридизованными в традиционном смысле этого слова. Можно сказать, что при таком подходе мы получаем скорее концепцию антигибридизации, чем гибридизации.
Разумеется, ни в 1928 г., ни даже в 1931 г. проведенный выше анализ был еще невозможен, так как пространственная симметрия молекулы учитывалась в то время только качественно, без привлечения математического аппарата теории групп. С исторической точки зрения необходимость введения концепции гибридизации была обусловлена потребностью объяснить в терминах метода ВС такие явления, как локализованный характер химических связей во многих соединениях, их направленность o в пространстве, аддитивность и трансферабельность ассоциируемых с отдельными связями молекулярных свойств, а также геометрию молекул. При этом геометрическим аспектам придавалось особое значение. По мнению Полинга и многих других химиков, именно гибридизация атомных орбиталей является фактором, определяющим симметрию молекулы, а отчасти и ее геометрические параметры. К сожалению, при этом произошло обращение причинно-следственных связей между гибридизацией и симметрией. Часто утверждают, что первая является причиной последней. Так, например, в молекуле метана промотирование электрона из 2s- в 2р-состояние с образованием 2s2р 3-конфигурации углерода позволяет образовать четыре эквивалентные АО, эффективно перекрывающиеся с 1s-AO атомов водорода. Очевидно, что при этих рассуждениях исходным пунктом является известная (тетраэдрическая) симметрия молекулы метана, из которой делается вывод о характере гибридизации в этой же молекуле. Но когда от этой молекулы переходят к другим насыщенным соединениям углерода и утверждают, что вследствие тетраэдрической гибридизации орбиталей атома углерода его соседи должны находиться в углах тетраэдра, то создается иллюзия, что причиной такой геометрической структуры этих соединений является тетраэдрическая гибридизация. В действительности же в основе этих рассуждений лежит несвязанное с концепцией гибридизации предположение о сходстве геометрической структуры рассматриваемых соединений. Более того, выполненные недавно детальные расчеты электронной структуры молекулы метана [89] для основной и искаженной геометрических конфигураций показали, что для тетраэдрической конфигурации полная электронная энергия этой молекулы отнюдь не o минимальна. Тетраэдрической конфигурации метана соответствует максимум полной электронной энергии (рис. 17)!
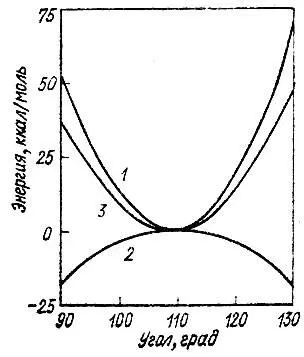
Рис. 17. Зависимость ядерной (1), электронной (2) и полной энергии (3) молекулы метана от валентного угла (T d→C 3U)
Возникает вопрос: почему же тогда для молекулы СН 4реализуется тетраэдрическая геометрия? Как видно из рис. 17 причиной образования такой высокосимметричной структуры является то, что для нее минимальной оказывается энергия Межъядерного отталкивания четырех атомов водорода [15] Следует отметить, что возможность такого объяснения геометрии молекул отмечали в 1930 г. Гайтлер и Румер [51].
. Таким образом, гибридизация АО не только не объясняет особенностей геометрического строения соединений углерода (и, очевидно, не только углерода), но в известной мере противоречит экспериментальным фактам. Конечно, противоречие снимается, если не пытаться объяснять геометрическое строение химических соединений гибридизацией образующих их атомов, а рассматривать определенный тип гибридизации как следствие определенной геометрии соединения.
Интервал:
Закладка:









