Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Название:Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1980
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи краткое содержание
Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Но не является ли тогда концепция гибридизации излишней? Было бы весьма печально, если б одно из фундаментальных понятий теории химической связи оказалось ненужным или даже ложным. Однако, как мы уже отмечали, объяснение геометрии молекул является лишь одной из задач, для решения которой привлекалась указанная концепция. Не менее важной являлась задача объяснения аддитивности и трансферабельности молекулярных свойств, обусловленных локализацией химических связей. Эта проблема в настоящее время успешно решается в рамках метода молекулярных орбиталей (см. гл. 4). Но уже в рамках метода ВС введенные Полингом представления о гибридизации позволили ему объяснить эквивалентность связей С-Н в метане, которая до этого казалась парадоксальной.
"Я тогда интересовался,- вспоминал впоследствии Полинг,- химическими связями, пытался понять, что они собой представляют. Это была головоломная проблема... Физики уверяли, что атом углерода имеет на внешней оболочке разные электроны — два s-электрона и два p-электрона — с разными, естественно, орбиталями. Но химики говорили, что этого не может быть, так как углерод образует четыре одинаковые связи... Как можно было примирить эти суждения? Я много размышлял над этой проблемой, и мне пришла в голову мысль, что s- и р-орбитали могут как-то сочетаться друг с другом, перемешиваться так, что образуются четыре одинаковые связи. Но подтвердить свою догадку точным математическим расчетом я не мог, задача была слишком сложна. Прошел почти год. И вдруг меня осенило, что смешанные, или гибридные, орбитали углерода можно рассчитать с помощью простых алгебраических действий. Для этого важно учесть зависимость электронных s- и р-орбиталей от направления в пространстве и сложить их так, чтобы гибридные орбитали приняли максимально вытянутую форму. В тех местах, где гибридные орбитали наиболее вытянуты, как раз и образуются химические связи между атомами" [19, с. 94-95]. При этом Полинг независимо от других исследователей ввел понятие о валентном состоянии атома в молекуле, отличном от его основного свободного состояния. Остановимся теперь более подробно на работе Полинга 1931 г. [72]. Обобщая метод Гайтлера-Лондона на многоатомные молекулы, он сформулировал шесть постулатов, отражающих основные свойства двухэлектронных связей.
1. Двухэлектронная связь образуется при взаимодействии неспаренных атомных электронов.
2. Образование связи сопровождается спариванием спиновых моментов отдельных электронов.
3. Спаренные электроны некоторой связи не могут одновременно принадлежать другим связям.
4. Для двухэлектронной связи определяющими являются те резонансные интегралы, которые включают лишь по одной атомной орбитали от каждого атома.
5. Из двух атомных орбиталей с одинаковой зависимостью более прочную связь образует та, амплитуда которой в направлении связи больше. Для заданной атомной орбитали связь образуется в направлении ее ориентации.
6. Из двух атомных орбиталей с общей угловой зависимостью более прочную связь обеспечивает орбиталь с меньшим средним радиусом (соответствующая более низкому энергетическому уровню).
Далее Полинг рассматривает случай двух атомов A и B, связанных двухэлектронной связью. Он полагает для простоты, что все прочие электроны в системе спарены и представляют собой или неподеленные пары, или пары электронов, связывающие атомы A и В с другими атомами. При этом Полинг предлагает использовать в качестве атомных орбиталей не только сферические функции, характеризуемые квантовыми числами l и m, но и их линейные комбинации, т. е. гибридные атомные орбитали. "Допустим,- пишет Полинг,- что атом А представляет для образования связи несколько одноэлектронных собственных функций приблизительно одинаковой энергии и что изменение в энергии проникновения в остов (атома) (in energy of penetration info the core) пренебрежимо мало по сравнению с энергией связи. Тогда мы можем принять для одноэлектронных собственных функций следующее выражение [16] Мы несколько видоизменили обозначения в приведенной формуле (3.45); n, l, m — квантовые числа; i-номер гибридной АО.
:
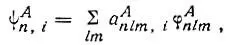 (3.45)
(3.45)
в котором 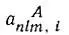 — численные коэффициенты, a
— численные коэффициенты, a 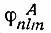 — определенный набор одноэлектронных собственных функций типа тех, которые получаются при разделении переменных в волновом уравнении в полярных координатах. Из функций ψ n,l A, можно образовать такую группу функций, которая будет относиться к атому Лик связанным с ним атомам, кроме атома B, так что все электроны оказываются спаренными, кроме одного... Из орбиталей атома В можно образовать аналогичную группу с одним неспаренным электроном.
— определенный набор одноэлектронных собственных функций типа тех, которые получаются при разделении переменных в волновом уравнении в полярных координатах. Из функций ψ n,l A, можно образовать такую группу функций, которая будет относиться к атому Лик связанным с ним атомам, кроме атома B, так что все электроны оказываются спаренными, кроме одного... Из орбиталей атома В можно образовать аналогичную группу с одним неспаренным электроном.
Тогда энергия взаимодействия двух групп может быть рассчитана с помощью вариационного принципа путем замены собственной функции молекулы на собственные функции этих двух групп так, чтобы при этом удовлетворялись требования симметрии" [72, с. 1369].
Иными словами, введенные Полингом гибридные орбитали должны определяться минимизацией полной энергии молекулы относительно коэффициентов  . Однако учитывая, что резонансные интегралы, определяющие в значительной степени полную энергию системы, тем больше, чем сильнее перекрываются соответствующие орбитали, Полинг предложил заменить вариационный критерий выбора гибридных АО более простым критерием их максимального перекрывания.
. Однако учитывая, что резонансные интегралы, определяющие в значительной степени полную энергию системы, тем больше, чем сильнее перекрываются соответствующие орбитали, Полинг предложил заменить вариационный критерий выбора гибридных АО более простым критерием их максимального перекрывания.
В частном случае, когда имеются s- и p-АО с одинаковыми и фиксированными радиальными функциями, перекрывание определяется исключительно угловой зависимостью атомных орбиталей. Эта угловая зависимость такова, что "р-электроны будут образовывать более прочные связи, чем s-электроны, причем связи, образованные р-электронами атома, ориентируются под прямыми углами относительно друг друга" [72, с. 1371]. Однако эти АО (s- и р-типа) могут быть преобразованы в гибридные орбитали, которые обеспечивают образование более прочных связей в определенных направлениях.
Таким образом, концепция гибридизации Полинга сводилась к предположению, что каждая гибридная атомная орбиталь ориентирована по определенной связи, т. е. ее угловая зависимость характеризуется максимальной амплитудой в направлении атома, связь с которым она обеспечивает. Следуя работе Гайтлера и Лондона, Полинг полагает, что взаимодействие между химически связанными атомами можно рассматривать как возмущение. Для учета последнего в случае вырождения энергетических уровней необходимо построение правильных функций нулевого приближения. Одна из этих функций соответствует наименьшей (отрицательной) энергии возмущения. Полинг предложил в качестве такой функции выбрать гибридную орбиталь,- ориентированную в направлении связи. В соответствии с теорией возмущений можно ожидать, что гибридизация будет тем более существенной, чем меньше разность энергий s- и р-АО по сравнению с энергией возмущения, обусловленной химическим взаимодействием. Вид гибридных орбиталей в некоторых случаях можно было определить из условий их ортонормированности и эквивалентности. Если бы 2s- и 2р-АО имели одинаковую радиальную зависимость
Читать дальшеИнтервал:
Закладка:









