Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Название:Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1980
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи краткое содержание
Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
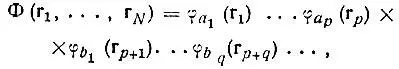 (3.31)
(3.31)
где  и т. п. При этом φ а1,...,φ аpмогут быть (в общем случае) не сферическими орбиталями изолированного атома, а их линейными комбинациями, т. е. гибридными атомными орбиталями.
и т. п. При этом φ а1,...,φ аpмогут быть (в общем случае) не сферическими орбиталями изолированного атома, а их линейными комбинациями, т. е. гибридными атомными орбиталями.
Совокупность всех орбиталей ф называется в методе ВС конфигурацией, а каждый из наборов (φ а1,...,φ аp)- валентной конфигурацией Г Aатома A. Некоторые из атомных орбиталей входят в Г Адважды (т. е. φ аi= φ аj) и называются спаренными. Число неспаренных орбиталей в конфигурации Г Аназывается спин-валентностью атома A, находящегося в соответствующем валентном состоянии. Это определение спин-валентности является обобщением, данным Лондоном. Действительно, если пренебречь гибридизацией атомных орбиталей, то оба определения станут идентичными, т. е. спин-валентность окажется равной мультиплетности основного (низшего) терма, уменьшенной на единицу.
Функция Φ домножается на функцию Θ(σ 1,...,σ N), зависящую от спиновых переменных всех электронов. Многоэлектронная функция Ψ, определяющая электронное состояние молекулы, должна быть собственной для оператора квадрата полного спинового момента 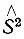 N-электронной системы, которую представляет молекула. Так как
N-электронной системы, которую представляет молекула. Так как 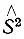 действует только на функцию Θ указанное условиt накладывает определенные ограничения только на Θ, но не на Φ.
действует только на функцию Θ указанное условиt накладывает определенные ограничения только на Θ, но не на Φ.
Подавляющее число веществ, способных к длительному существованию, состоит из молекул с нулевым полным спином, т. е. находится в синглетном состоянии. Для простоты изложения в дальнейшем будут рассматриваться только такие молекулы.
Каждой атомной орбитали φ соответствует одна из двух одноэлектронных спиновых функций α(σ) и β(σ) , которые являются собственными для одноэлектронного оператора проекции спинового момента на ось квантования [см. (3. 19)].
Функция Θ может быть построена из одноэлектронных спиновых функций следующим образом:
• из пары функций α(σ) и β(σ) составляется двухэлектронная функция
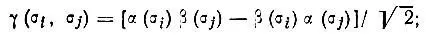 (3.32)
(3.32)
• перемножением N/ 2функций γ, зависящих от спиновых переменных различных электронов, получается функция
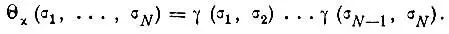 (3.33)
(3.33)
Необходимость индексации функции Θ обусловлена неоднозначностью ее построения из функций γ.
Если конфигурация N-электронной системы содержит п неспаренных АО, то, как это было показано Гайтлером и Румером [51-52], можно построить 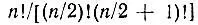 линейно-независимых Θ χ. Например, для π-электронной системы бензола, включающей шесть электронов и столько же атомных π-орбиталей, можно построить пять независимых Θ χ(χ = 1,...,5).
линейно-независимых Θ χ. Например, для π-электронной системы бензола, включающей шесть электронов и столько же атомных π-орбиталей, можно построить пять независимых Θ χ(χ = 1,...,5).
Таким образом, оказывается необходимым рассмотрение функции вида
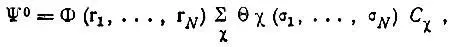 (3.34)
(3.34)
содержащей числовые коэффициенты С χ, которые должны определяться минимизацией полной электронной энергии молекулы.
Согласно принципу Паули, функция состояния многоэлектронной системы должна быть антисимметричной относительно всевозможных перестановок (r iσ i) → (r j, σ j). Функция Ψ 0, однако, такой не является, и поэтому ее следует антисимметризовать. Учитывая, что Ф является произведением орбиталей φ, легко видеть, что процедура антисимметризации сохраняет соответствие между парой орбиталей {φ i, φ j} и некоторой двух-электронной спиновой функцией у для каждого слагаемого в сумме (3.34), характеризующегося некоторым индексом χ и называемого структурой ВС. Можно сказать поэтому, что орбитали φ iи φ jв некоторой структуре ае спарены. Таким образом, одно из центральных понятий ранних квантовохимических работ — понятие спаривания электронов (точнее, атомных орбиталей) — сохраняется и в более общей теории при правильном учете принципа антисимметрии.
Если каждой орбитали φ iсопоставить точку на плоскости, то спаривание двух орбиталей можно представить графически отрезком, соединяющим две соответствующие точки. Так, например, одна из структур молекулы аммиака NH 3может быть представлена диаграммой I (рис. 14). Здесь прерывистой линией обведена группа точек, соответствующих орбиталям атома азота. Стягивая каждую из таких групп в одну точку, можно получить диаграмму II связей атомов в структуре ВС. Аналогично для молекулы азота N 2получаем диаграмму III.
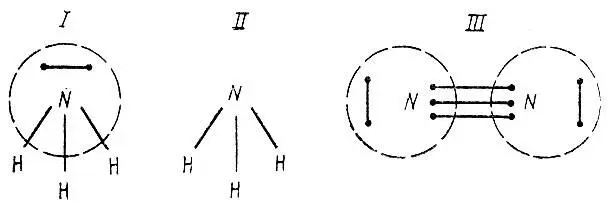
Рис. 14. Диаграммы связей атомов в молекулах NH 3и N 2
Иногда возможно с достаточной степенью точности представить электронное строение молекулы одной структурой (приближение идеального спаривания). Тогда кратность связи атомов отождествляется с числом штрихов, соединяющих соответствующие этим атомам группы точек на диаграмме связей, а сами диаграммы вида II становятся идентичными химическим структурным формулам.
В других случаях необходимо учитывать несколько структур . Например, для молекулы бензола следует принимать во внимание по крайней мере две структуры Кекуле. В таких "неклассических" случаях значения кратностей связей должны, очевидно, усредняться по структурам с учетом веса (ω χ) каждой структуры χ в разложении полной многоэлектронной функции Ψ:
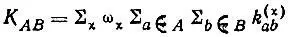 (3.35)
(3.35)
где 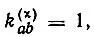 если атомные орбитали аиЬ спарены в структуре χ; 0 — в противном случае;
если атомные орбитали аиЬ спарены в структуре χ; 0 — в противном случае;
А и В обозначают атомы и с оответствующие им наборы атомных орбиталей.
Вес структур зависит, вообще говоря, как от коэффициентов С χ, так и от перекрывания соответствующих многоэлектронных функций. Вследствие неортогональности последних понятие веса не является ни простым, ни однозначным. Удовлетворительное определение этого понятия, к сожалению, до сих пор отсутствует. Однако в ряде случаев вес структур определяется исключительно из соображений симметрии. Для π-электронной системы бензола, например, вес двух кекулевских структур (рис. 15) одинаков, так как эти структуры эквивалентны по симметрии. Поэтому если пренебречь прочими структурами, то ω χ= 0,5 (χ = 1,2), и с учетом σ-системы, описываемой в приближении идеального спаривания единственной структурой, кратность связи двух соседних атомов углерода равна
Читать дальшеИнтервал:
Закладка:









