Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Название:Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1980
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи краткое содержание
Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
и
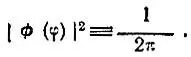 (2.22)
(2.22)
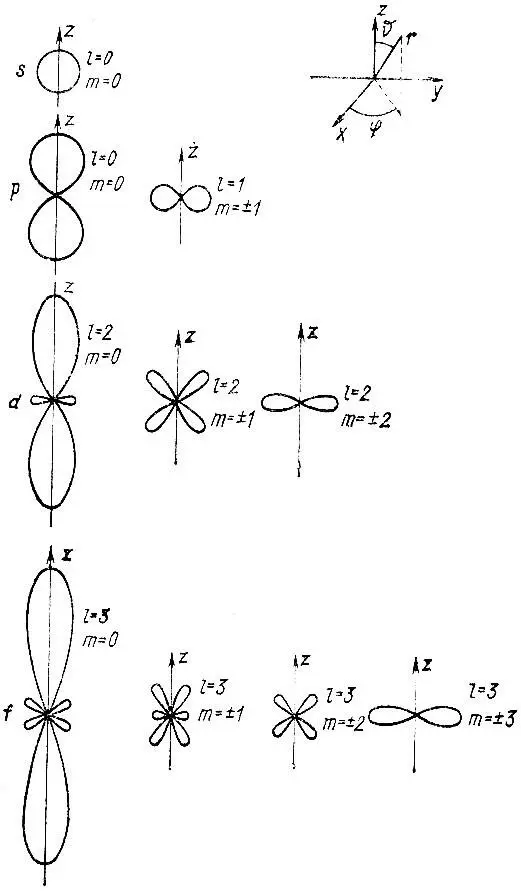
На рис. 7 приведены сечения полярных диаграмм плоскостью yz . Полные поверхности получаются вращением их вокруг оси z .
 ">
">
Рис. 7. Полярные диаграммы 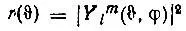
Изовероятностные поверхности.Соответствующее атомным орбиталям распределение плотности вероятности локализации электрона в определенной точке трехмерного пространства может характеризоваться семейством изовероятностных поверхностей (или поверхностей равной вероятности), определяемых уравнением
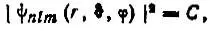 (2.23)
(2.23)
где С — некоторая константа.
В частности, распределение электронной плотности, соответствующее ns -орбитали, описывается одной или несколькими (в зависимости от значения главного квантового числа n и конкретного значения константы С ) концентрическими сферами: для 1s — одна сфера радиуса n(С) , для 2s — либо одна сфера радиуса r 1(C)(C 2< C≤ C 1), либо две сферы радиусов r 1(C) и r 2(C)(С = С 2), либо три сферы радиусов r 1(С), r 2(С) и r 3(С)(0<���С<���С 2) (рис. 8).
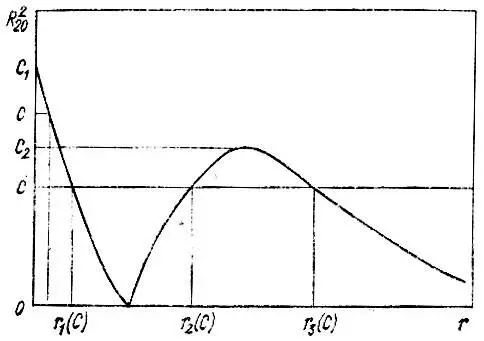
Рис. 8. К определению изовероятностных поверхностей для 2s-АО
В качестве других примеров на рис. 9 приведены изовероятностные поверхности для 1s-, 2s-, 2p-, 3s-, 3p- и Зd-орбиталей атома водорода.
Вещественные атомные орбитали.До сих пор мы рассматривали комплексные атомные орбитали, характеризующиеся определенными значениями проекции орбитального момента импульса. Однако в квантовой химии часто используют вещественные комбинации таких орбиталей, определяемые по формулам
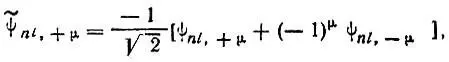 (2.24)
(2.24)
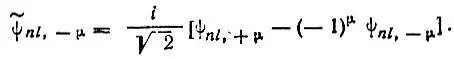 (2.25)
(2.25)
Здесь индекс μ = |m| уже не имеет смысла проекции момента импульса. К сожалению, на это обстоятельство не всегда обращают внимание. Во многих учебниках состояние электрона в атоме характеризуется квантовыми числами n , l и m , а для иллюстрации приводятся графические изображения вещественных АО.
Если выразить 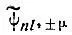 через декартовы координаты (x, y, z), то каждая из этих функций окажется пропорциональной некоторому полиному от х, у и z, который обычно указывается при
через декартовы координаты (x, y, z), то каждая из этих функций окажется пропорциональной некоторому полиному от х, у и z, который обычно указывается при 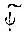 вместо индекса μ.
вместо индекса μ.
Легко убедиться, что между комплексными и вещественными атомными орбиталями существует следующее соответствие:
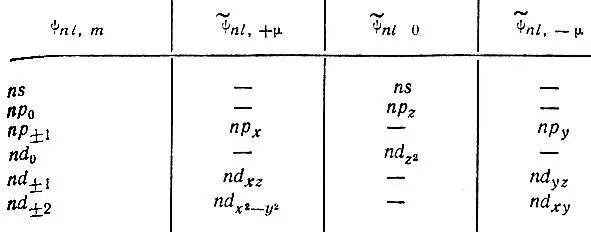
Поверхности, представляющие вещественные 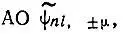 могут не обладать аксиальной симметрией (рис. 10).
могут не обладать аксиальной симметрией (рис. 10).
О порядке заполнение атомных орбиталей
Как правило, порядок заполнения электронных nl -оболочек по мере увеличения атомного номера элемента: 1s, 2s, 2р, 3s, 3р, 4s, 3d, 4р, 5s,..,-объясняется тем, что орбитальные энергии в многоэлектронном атоме возрастают в той же последовательности. Так, например, "опережающее" заполнение 4s-АО в атомах К и Са по сравнению с 3d-AO связывают с тем, что ε 4s< ε 3d. Hо тогда встает вопрос: почему ε 4s< ε 3d. Обычно ответ сводится к тому, что преимущество 4s-AO обусловлено наличием трех "внутренних" локальных максимумов, которые обеспечивают их большее проникновение в остов по сравнению с 3d-AO, не имеющими таких максимумов.

Рис. 9. Изовероятностные поверхности для 1s, 2s, 2p, 3s, 3p и 3d-AO, характеризуемых определенными значениями проекции момента импульса m числа на рисунке)
Однако это объяснение нельзя признать удачным. Во-первых, разница в узловой структуре орбиталей одинаковой симметрии сама по себе еще не гарантирует определенное соотношение их энергий. Во-вторых (и это самое важное!), появление локальных максимумов, обусловленных ортогональностью 4s-АО к s-орбиталям остова, следует рассматривать скорее как проявление эффекта "выталкивания" этих орбиталей из остова. Не будь условий ортогональности, 4s-орбиталь "провалилась" бы в остов, превратившись в безузловую 1s-AO, имеющую только один большой максимум на ядре. Следует также заметить, что учет условий ортогональности возможен и при использовании безузловых 4s-орбиталей, но с соответствующей заменой потенциала эффективного поля, действующего на описываемые этой орбиталью электроны, псевдопотенциалом, который отличается от исходного некоторой положительнойдобавкой. Иными словами, условия ортогональности должны приводить к увеличению орбитальных энергий.

Рис. 10. Изовероятностные поверхности для вещественных 1s, 2s, 2p, 3s, 3p и 3d-AO
На самом деле порядок заполнения орбиталей обусловлен не отношением их энергий, а требованием минимума полной энергии атома, которая, как отмечалось выше, отлична от суммы одноэлектронных энергий. Более того, сами энергии орбиталей зависят от выбора конфигураций, т. е. от порядка их заполнения. Приходится признать, что порядок заполнения АО, определяющий структуру периодической системы, пока еще не нашел удовлетворительного объяснения.
* * *
В заключение этой главы отметим, что понятие об атомных орбиталях является одним из основных понятий современной теории химической связи. Это проявляется, в частности, в том, что приближенные многоэлектронные волновые функции, описывающие электронную структуру молекул, обычно строятся из орбиталей атомов, образующих рассматриваемую молекулу. Способы построения таких приближенных функций могут быть различными. Именно этим различием обусловлено существование нескольких квантовохимических методов исследования природы химической связи, специфика и историческое развитие которых обсуждаются в следующей главе.
Читать дальшеИнтервал:
Закладка:









