Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
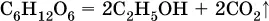
Этиленгликоль получают в двухстадийном процессе:
а) окисление этилена:
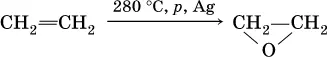
б) гидратация этиленоксида:
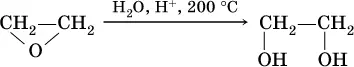
Глицерин ранее получали омылением жиров (см. 20.3), современный трехстадийный способ – постепенное окисление пропена (приведена только схема процесса):
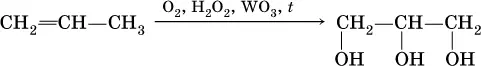
Спирты используют как сырье в органическом синтезе, в качестве растворителей (для лаков, красок и т. п.), а также в бумажной, полиграфической, парфюмерной, фармакологической и пищевой промышленности.
Простые эфиры– класс органических соединений, содержащих мостиковый атом кислорода – О– между двумя углеводородными радикалами: R – О—R'. Самый известный и широко применяемый простой эфир – диэтиловый эфир С 2Н 5—О – С 2Н 5. Бесцветная, легкоподвижная жидкость с характерным («эфирным») запахом, в лабораторной практике его называют просто эфиром. Почти не смешивается с водой, t кип= 34,51 °C. Пар эфира воспламеняется на воздухе. Получают диэтиловый эфир при межмолекулярной дегидратации этанола (см. выше), основное применение – растворитель.
Фенолы– это спирты, в которых группа ОН непосредственно связана с бензольным кольцом. Простейший представитель — фенол С 6Н 5—ОН. Белые (розовеющие на свету) кристаллы с сильным запахом, t пл= 41 °C. Вызывает ожоги кожи, ядовит.
Для фенола характерна значительно большая кислотность, чем для ациклических спиртов. Вследствие этого фенол в водном растворе легко реагирует с гидроксидом натрия:
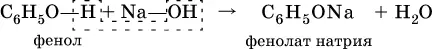
Отсюда тривиальное название фенола — карболовая кислота.
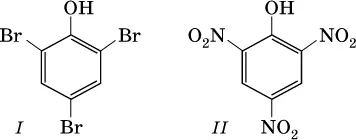
Отметим, что группа ОН в феноле никогда не замещается ни на какие другие группы или атомы, но делает более подвижнымиатомы водорода бензольного кольца. Так, фенол легко реагирует с бромом в воде и азотной кислотой, образуя соответственно 2,4,6-трибромфенол (I) и 2,4,6-тринитрофенол (II, традиционное название — пикриновая кислота):
Фенол в промышленностиполучают нагреванием хлорбензола с раствором гидроксида натрия под давлением при 250 °C:
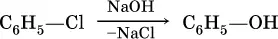
Фенол применяют в качестве сырья для производства пластмасс и смол, полупродуктов для лакокрасочной и фармацевтической промышленности, как дезинфицирующее средство.
10.2. Альдегиды и кетоны
Альдегиды и кетоны– это производные углеводородов, содержащие функциональную карбонильную группу СО. В альдегидах карбонильная группа связана с атомом водорода и одним радикалом, а в кетонах с двумя радикалами.
Общие формулы:
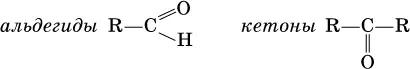
Названия распространенных веществ этих классов приведены в табл. 10.
Метаналь – бесцветный газ с резким удушающим запахом, хорошо растворим в воде (традиционное название 40 %-ного раствора— формалин), ядовит. Последующие члены гомологического ряда альдегидов – жидкости и твердые вещества.
Простейший кетон – пропанон-2, более известный под названием ацетон, при комнатной температуре – бесцветная жидкость с фруктовым запахом, t кип= 56,24 °C. Хорошо смешивается с водой.
Химические свойства альдегидов и кетонов обусловлены присутствием в них карбонильной группы СО; они легко вступают в реакции присоединения, окисления и конденсации.

В результате присоединенияводорода к альдегидамобразуются первичные спирты:
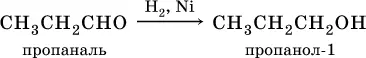
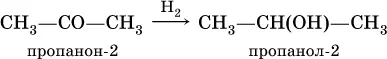
При восстановлении водородом кетоновобразуются вторичные спирты:
Реакция присоединениягидросульфита натрия используется для выделения и очистки альдегидов, так как продукт реакции малорастворим в воде:
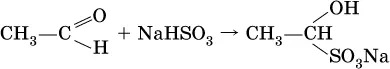
(действием разбавленных кислот такие продукты превращаются в альдегиды).
Окислениеальдегидов проходит легко под действием кислорода воздуха (продукты – соответствующие карбоновые кислоты). Кетоны сравнительно устойчивы к окислению.
Альдегиды способны участвовать в реакциях конденсации. Так, конденсация формальдегида с фенолом протекает в две стадии. Вначале образуется промежуточный продукт, являющийся фенолом и спиртом одновременно:
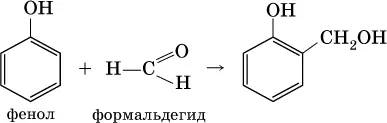
Затем промежуточный продукт реагирует с другой молекулой фенола, и в результате получается продукт поликонденсации— фенолформальдегидная смола:
Качественная реакция на альдегидную группу – реакция «серебряного зеркала», т. е. окисление группы С(Н)O с помощью оксида серебра (I) в присутствии гидрата аммиака:
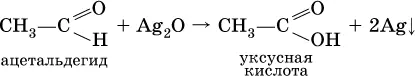
Аналогично протекает реакция с Cu(ОН) 2, при нагревании появляется красный осадок оксида меди (I) Cu 2O.
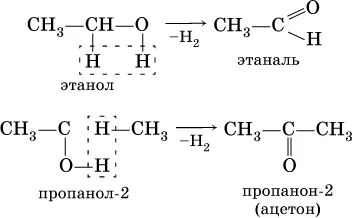
Получение : общий способ для альдегидов и кетонов – дегидрирование (окисление) спиртов. При дегидрировании первичныхспиртов получают альдегиды, а при дегидрировании вторичных спиртов – кетоны. Обычно дегидрирование протекает при нагревании (300 °C) над мелкораздробленной медью:
При окислении первичных спиртов сильнымиокислителями (перманганат калия, дихромат калия в кислотной среде) процесс трудно остановить на стадии получения альдегидов; альдегиды легко окисляются до соответствующих кислот:
Читать дальшеИнтервал:
Закладка:










