Эрик Роджерс - Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра
- Название:Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра
- Автор:
- Жанр:
- Издательство:Мир
- Год:1973
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Эрик Роджерс - Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра краткое содержание
Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
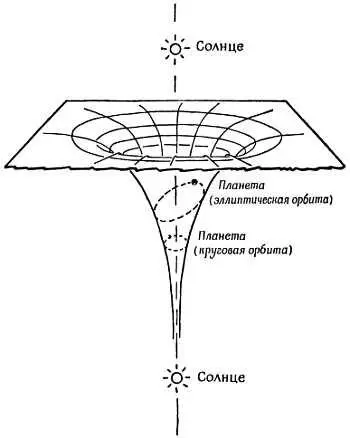
Фиг. 191. Энергетический холм (яма).
Диаграмма для солнечной системы (из книги К. Mendelsshon , What is Atomic Energy, Sigma Books, Ltd.).
Аналогичной была бы «диаграмма холма» для ядра и электронов в «атоме Резерфорда без квантовых ограничений». На фиг. 192 показана упрощенная «диаграмма холма» атома с набором «квантовых уступов» для круговых орбит. В схеме Бора были учтены также другие уступы (уровни энергии), отвечающие эллиптическим орбитам. Форма, размеры и другие характеристики каждой орбиты были определены несколькими квантовыми числами.
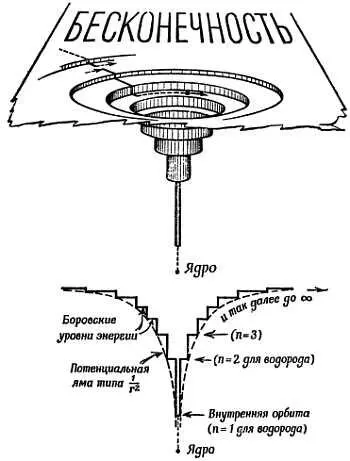
Фиг. 192. Энергетический холм (яма).
Диаграмма для модели атома Бора (из книги К. Mendelsshon , What is Atomic Energy, Sigma Books, Ltd.).
Низший уступ, определенный по квантовым правилам Бора значением n = 1, дает наименьшую разрешенную орбиту. Здесь энергия электрона минимальна; эта орбита наиболее стабильна, поэтому можно было бы ожидать, что электрон будет падать вниз до этого уровня, если только это возможно, и останется здесь. Действительно, следовало бы спросить: почему же не все электроны падают на этот нижний уступ, а все атомы не сжимаются до минимальных размеров? Мы знаем, что так не происходит, и это была одна из многих тайн, которые вскоре объяснились правилом, сформулированным В. Паули под названием принципа исключения [192]. Здесь принцип в сущности утверждает, что на уступе может находиться лишь один электрон, только один электрон с данным набором квантовых чисел. Никогда, ни в каком атоме несколько электронов не могут занимать совершенно одинаковые орбиты. Теперь, правда, мы удваиваем каждый выступ, чтобы поместить туда два электрона с противоположными спинами. С помощью современных знаний можно обосновать принцип Паули, однако долгое время он оставался произвольным, но очень полезным руководством для моделей атома.
В сущности Бор сказал: «Электроны не могут непрерывно излучать; атомы не подчиняются традиционным законам физики. Если вы примете мое смелое предположение, факты обретут больше смысла». А Паули добавил ограничительное правило: «Только один электрон на орбите». Эти правила выглядят как законодательство, основанное на декретах, но они успокаивают волнение, вызванное парадоксами атомной модели, обогащая знания. Они дали Бору возможность вычислить универсальную постоянную спектра, исходя из фундаментальных компонент е, h, с, e / m , и плодотворно объяснили все спектры, которые вскоре после объяснения перешли в разряд решенных проблем, и осветили другие нерешенные проблемы. Еще когда Бор продолжал развивать свои правила, Мозли использовал их в грубой теории спектров рентгеновских лучей, что позволило ему измерить атомные номера, — почти перед этим стал понятен смысл атомного номера с точки зрения строения атома, содержащего ядро.
Правила Бора, например, предсказывают диаметр обычного атома водорода, который уже был экспериментально известен из грубых измерений.
Размеры атома водорода
Общие размеры атома водорода определяются диаметром орбиты 2 r единственного электрона, вращающегося вокруг ядра атома (в модели Бора). Два атома, удаленные на расстояние больше 2 r , будут нейтральными друг для друга и не смогут взаимодействовать с большой силой. При расстоянии между атомами меньше 2 r орбиты их электронов окажутся перекрывающимися, и здесь должны возникнуть нарушения, приводящие к притяжению, а при еще меньших расстояниях — к отталкиванию [193]. Таким образом, величина 2 r должна определять «диаметр» атома при слабых столкновениях и, возможно, при образовании молекул. Экспериментальные оценки (грубые из длины молекулы масла и хорошие из данных о внутреннем трении в газообразном водороде) показывают, что «диаметр» атома водорода немного больше 1 А° (10 -10м). Ниже показано, как Бор вычислил величину 2 r с помощью своих квантовых правил.
Квантовое правило Бора mv∙2 π r= n hдля электрона на самой низшей, наиболее стабильной орбите с n = 1 даст mv∙2 π r= h, или mv= h/2 π r. Электроны удерживаются на своих орбитах в атоме притяжением заряда ядра Z e , которое обратно пропорционально квадрату расстояния, так что
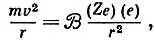
причем для водорода Z = 1.
Используем алгебру, чтобы исключить отсюда орбитальную скорость электрона и найти радиус орбиты через h , и т. п.:
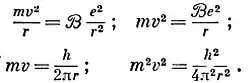
Разделив первое равенство на последнее, получим
т. е. радиус орбиты равен
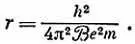
Используем экспериментальные значения:
h (по Планку или Милликену)… 6,62∙10 -34дж∙сек;
(из измерений силы, действующей на заряд в электрическом поле)… 9,00∙10 9 ньютон∙м 2/кулон 2;
е (Милликен)… — 1,60∙10 -19кулон;
m (из значения е по Милликену и e / m по отклонению заряда в полях)… 9,11∙10 -31кг.
Тогда
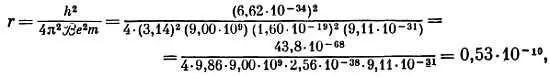
а в качестве размерности для r получается
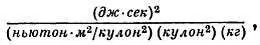
что сводится к метру .
Здесь было приведено предсказание Бора для размеров атома водорода, полученное математически. Посмотрите на исходные величины:
h — постоянная Планка для квантов излучения; — постоянная в законе Кулона; е и m — заряд и масса электрона. Вывод: диаметр электронной орбиты в невозбужденном атоме водорода 1,06∙10 -10м, или ~ 1 A°; «размер атома», в хорошем согласии с прямыми измерениями.
Бор и спектры — электронные гармоники?
Крупнейшим достижением теории Бора было предсказание ею спектра излучения раскаленного водорода. Этот линейчатый спектр был другим парадоксом, нуждавшимся в объяснении, — экспериментальные формулы требовали простой теории. Если раскаленные добела твердые вещества излучают сплошной спектр «черного тела», то пылающие газы (разогретые или возбужденные электрическим разрядом) дают совершенно иной спектр. Анализ их излучения показывает, что в спектре отсутствует свет большей части цветов, а имеются лишь очень узкие и очень яркие полоски определенных цветов, т. е. спектр состоит из ярких «линий», каждой из которых соответствует практически одна длина волны (см. гл. 10 ). У каждого газа есть свой характерный набор линий: красная линия (и много других) у неона; желтая (и несколько ультрафиолетовых) у паров натрия (которые можно получить, поместив поваренную соль в пламя) и т. д. Длины волн ярких спектральных линий имеют вполне определенную величину для атомов каждого элемента. Они дают первоклассный способ анализа любых материалов — будь то образцы промышленных изделий или газы в далеких звездах. Линии каждого элемента группируются вдоль спектра в правильные серии с переменным шагом. С помощью выполненных в прошлом веке тщательных измерений длин волн было рассортировано много таких серий. В расположении каждой серии явно наблюдается некоторая система. Для водорода и некоторых других газов из измерений было получено очень простое основное правило, отражающее такую систему.
Читать дальшеИнтервал:
Закладка:








