А. Березовчук - Физическая химия: конспект лекций
- Название:Физическая химия: конспект лекций
- Автор:
- Жанр:
- Издательство:Конспекты, шпаргалки, учебники «ЭКСМО»b4455b31-6e46-102c-b0cc-edc40df1930e
- Год:2009
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
А. Березовчук - Физическая химия: конспект лекций краткое содержание
Данное учебное пособие предназначено для студентов химических факультетов высших учебных заведений педагогического и технического направления. Изложены основные концепции и процессы, составляющие современную физическую химию. Материал соответствует государственному стандарту. Пособие рекомендовано в помощь студентам при подготовке к экзаменам.
Физическая химия: конспект лекций - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
6. Моделирование электрохимических процессов
Моделирование электрохимических процессовсостоит в следующем. На основе системы уравнений, лежащих в основании какого-либо электрохимического металлического исследования, составляется программа для исследуемого электрохимического процесса с учетом предполагаемого механизма этого процесса и лимитирующих стадий. Задаются исходные параметры ( i , потенциал, t, c, η, коэффициент переноса заряда) и с помощью компьютера проводится расчет.
7. Метод гальваностатических кривых
В этом методе анализируется зависимость Е, t при заданной i .
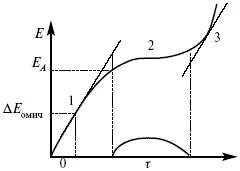
Рис. 15.1, 3 – резкое изменение потенциала, где наступает заряжение ДЭС (изменение заряда поверхности); Δ E/ Δ t– угловой коэффициент наклона, по нему можно рассчитать емкость ДЭС.
Для этого необходимо кривую записывать с помощью осцилирования, так как заряжение ДЭС происходит в течение тысячных долей секунды. В обычных условиях прибора КСП-4 кривую можно зарегистрировать с точностью до 0,1 с, определяемую по угловому коэффициенту; емкость является поляризационной емкостью (псевдоемкость). Она характеризует количество адсорбированных частиц на электроде, которые вступают в электрохимическую реакцию. Потенциал начала реакции, где первая дуга переходит во вторую – Е a. Участок 2 характеризует время протекания электрохимической реакции. Из точек пересечения касательных опускаем перпендикуляр и находим отрезок, τ – переходное время процесса, i x τ = Q– количество образовавшегося продукта. Можно на основе определения переходного времени процесса при различных плотностях тока анализировать зависимость τ от i . Для замедленной стадии диффузии, лимитирующей скорость суммарного электрохимического процесса, зависимость между переходным временем и плотностью тока:
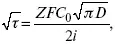
F – число Фарадея;
С 0– объемная концентрация ионов в растворе;
D – коэффициент диффузии.
В случае замедленной диффузии
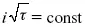
(зависит только от концентрации раствора) по угловому коэффициенту наклона прямой можно рассчитать коэффициент диффузии.
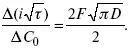
Знание зависимости переходного времени от i позволяет определить const скорости химической стадии и Кр; если электрохимическая реакция лимитируется замедленной предшествующей химической стадией то например: при катодном выделении Н 2
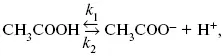
k 2 – const молизации, k р= k 1/k 2.

τ в химической стадии будет меньше ∑ τ на величину, определяемую const скорости замедленной химической стадии.
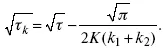
Кроме того, определение переходного времени позволяет графически находить адсорбцию веществ, участвующих в процессе. Количество электричества, определяемое длиной задержки на Е, t кривых, складывается из количества электричества, которое идет на протекание электрохимической реакции и может быть определено через долю τ , связанную с диффузией вещества к поверхности элект-рода и с адсорбцией вещества на электроде
iτ = iτ д+ iτ адс.
При высоких плотностях тока доля электричества, которое тратится на электрохимическое превращение диффундирующих частиц, → 0.
iτ ≈ iτ адс, iτ адс= Г
где Г – величина адсорбции.
Существует несколько механизмов протекания электрохимических реакций с участием адсорбированных частиц:
1) сначала в реакцию вступают частицы, адсорбированные на поверхности электрода, а потом те, которые подходят к поверхности за счет диффузии – «сначала адсорбат»;
2) «адсорбат потом» – сначала электрохимическому превращению подвергаются диффузионные частицы, а затем те, которые адсорбируются на поверхности;
3) выполняется в тех случаях, когда поверхностная концентрация реагирующих частиц и их концентрация у поверхности подчиняется уравнению линейной изотермы адсорбции;
4) когда соотношения скоростей восстановления адсорбированных частиц и частиц диффундирующих из объема раствора, их концентрация не зависит от времени:
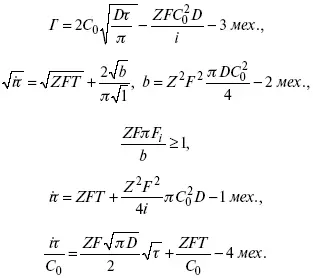

ЛЕКЦИЯ № 15. Третий закон термодинамики
Понятие химического сродства.Известно, что многие вещества реагируют друг с другом легко и быстро, другие вещества реагируют с трудом, а третьи – не реагируют. Исходя из этого, вывели предположение, что между веществами существует какое-то химическое сродство.
1-е предположение – мерой химического сродства была скорость реакции.
2-е предположение – М. Бертло и Х. Томсон высказали, что мерой химического сродства является тепловой эффект.
3-е предположение – max А (Вант-Гофф). Если max А > 0, то химическое сродство между веществами существует, и реакция протекает слева направо. Если А max < 0 →, то химического сродства между веществами нет, и реакция протекает справа налево. Если А max = 0, то реакция протекает и туда, и обратно. На основе этого создавался третий закон термодинамики; М. Бертло и Х. Томсон , изучая поведение термодинамических систем при низких температурах, в 1906 г. обнаружили, что при низких температурах между веществами существует так называемое химическое сродство, которое они определили как тепловой эффект, ими было установ-лено, что тепловой эффект Q v– А maxв конденсированных системах при низких температурах, где А max – максимальная работа.
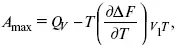
но на самом деле это не max, если исходить из уравнения Гельмгольца.
Для того, чтобы работа была max, она должна равняться тепловому эффекту A max= Q v, надо вычислить:
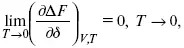
Δ F = Q v.
Читать дальшеИнтервал:
Закладка:










