Ахун Андижани - Хамса. Пятерица
- Название:Хамса. Пятерица
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2022
- Город:Санкт-Петербург
- ISBN:978-5-907557-71-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ахун Андижани - Хамса. Пятерица краткое содержание
Хамса. Пятерица - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Электронные оболочки
Удерживаемые атомным ядром электроны находятся в различных состояниях – на определённых «орбитах»-оболочках. На каждой оболочке может находиться ограниченное число электронов. Сами оболочки-уровни строго определяются атомным ядром и тем обстоятельством, что электрон, как и устойчивая волна, может существовать в ограниченном пространстве только в том случае, когда в этом пространстве укладывается целое количество волн. На каждой оболочке при соответствующем атомном ядре энергия электрона строго определена.
Отдельный атом находится в наиболее устойчивом или, как говорят физики, в основном состоянии, когда электронами заполнены всевозможные (при данном количестве электронов) состоянии с наименьшей энергией.
В определённых условиях – при достаточно сильном воздействии окружающей среды (подводе энергии из окружающей среды) – атом выводится из основного состояния, но быстро возвращается в основное состояние, испустив лишнюю энергию в виде γ-кванта. Энергия γ-кванта, или фотона, при этом соответствует разности уровня энергий покинутого состояния приобретённого.
При очень большом воздействии окружающей среды какой-либо электрон (находившийся в наименее устойчивом состоянии с относительно большим уровнем энергии) может получить энергию, позволяющую ему покинуть атом. Минимальная такая энергия называется ионизационным потенциалом рассматриваемого атома. На фигуре 5 приведены уровни энергий отдельного атома водорода. В газообразном водороде при комнатной температуре практически все атомы находятся в основном состоянии, а электроны находятся на оболочке с уровнем энергии – 13,6 эв. Если этот газ нагреть достаточно сильно, то некоторые атомы, сталкиваясь между собой, уже смогут приобрести кинетическую энергию, превышающую 10,2 эв. Электрон перейдёт с низшего уровня на более высокие. Наличие вакантного места на оболочке первого уровня заставит электрон, испустив соответствующий фотон или фотоны, вернуться в прежнее состояние.
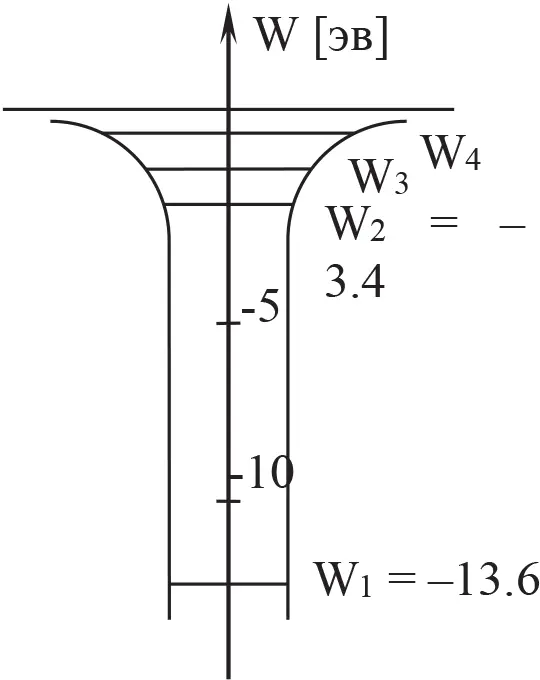
Фиг. 5
При переходе с высокого уровня на первый в атоме водорода излучается ультрафиолетовый свет, при переходе с высокого уровня на второй – излучается фотон видимого спектра.
Если при столкновении кинетическая энергия превысит 13,6 эв., то электрон может получить энергию, позволяющую ему покинуть протон – ядро водорода, то есть 13,6 эв., – ионизационный потенциал электрона.
Как было сказано выше, количество электронов, способных находиться на определённой оболочке, ограничено.
Количество электронов на внешней оболочке атома, находящегося в основном состоянии (и соответствующее количество электронов, недостающих до полной заполненности внешней оболочки) определяет основные химические свойства атомов (валентность, ионизационные потенциалы и т. д.).
Этим обусловлена периодичность свойств атомов, при возрастании атомного номера определяющая таблицу Менделеева. Замыкают каждый период атомы с полностью укомплектованными оболочками – инертные газы.
Чтобы вывести стабильный, отдельный атом из устойчивого состояния, необходимо внешнее достаточно мощное воздействие, имеющее энергию не меньше, чем энергия ионизации этого атома. На фигуре 6 приведён график зависимости энергии ионизации от атомного номера.
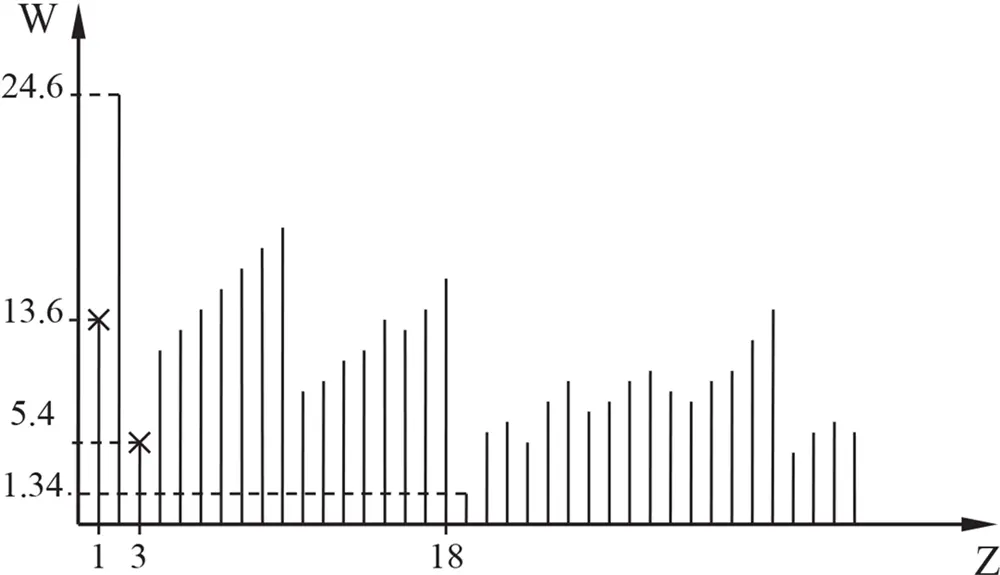
Фиг. 6. Ионизационные потенциалы атомов
На графике видно, что с увеличением номера периода средняя энергия ионизации атомов периода уменьшается. То есть с увеличением номера периода устойчивость атомов – необходимая энергия воздействия для ионизации – сравнительно падает. Напомним, что атомное ядро при увеличении Z также становится менее устойчивым. Этими обстоятельствами предопределяется сравнительно большая распространённость «лёгких» атомов как на Земле, так и в исследованной Вселенной.
Ионы и устойчивость
На фигуре 6 видно, что ионизационный потенциал лития равен 5,4 эв. То есть для того, чтобы наименьше связанный электрон (электрон внешней оболочки) лития покинул систему атома, достаточно энергии в 5,4 эв. Такая энергия вполне достижима при давлении 1 атм. и определённой температуре. Для сравнения напомним, что электрон в атоме водорода возбуждается (переходит с первой оболочки на вторую) при получении энергии в 10,2 эв.
Второй ионизационный потенциал лития (соответствующий освобождению второго электрона – одного из обитателей внутренней оболочки) равен 75,6 эв., что примерно в три раза превышает ионизационный потенциал самого инертного (устойчивого) атома среди всех элементов атома гелия (24,6 эв.).
Приведённый пример иллюстрирует тот факт, что в определённых условиях (при наличии только лития и его ионов определённой температуры, плотности и т. д.) некоторые химически неравновесные состояния могут быть – по общему определению устойчивости – более устойчивы, чем химически равновесные состояния. Так как литий в ионизированном состоянии (в определённых условиях) выдерживает, не изменяя своих основных свойств (ионизированность и т. д.) большие воздействия окружающей среды (в указанных условиях), чем литий в равновесном состоянии (с электростатической точки зрения).
В ионизированном состоянии реализуется обобщённо равновесное состояние, в котором уравновешиваются силы отталкивания и притяжения заряженных частиц при довольно высоком уровне механических воздействий окружающей среды.
Благородные газы
В каждом периоде наиболее устойчивыми атомами являются атомы с полностью укомплектованными внешними оболочками – атомы инертных газов.
Это объясняется, во-первых, полной укомплектованностью внешней оболочки – новому кандидату, электрону, нет места в системе – все разрешённые состояния электронов на всех уровнях, вплоть до внешней оболочки, заняты.
Во-вторых, следующая оболочка, где вроде ни одно состояние не занято, достаточно удалена от ядра и электронов внешней оболочки; сил притяжения, удерживающих какую-либо движущуюся частицу, на ней нет. Все внутренние силы полностью уравновешены.
И, в-третьих, электроны внешней оболочки связаны с атомом силой, максимально возможной на этом энергетическом уровне. Положительный заряд совокупности частиц (без электронов внешней оболочки), действующий на внешнюю оболочку, максимален.
Для сравнения: в атомах щелочных металлов (начинающих периоды – лития, натрия, калия) положительный потенциал создаётся только одним зарядом (остальные уже скомпенсированы).
Читать дальшеИнтервал:
Закладка:










