Наталья Бурханова - Теплотехника
- Название:Теплотехника
- Автор:
- Жанр:
- Издательство:Конспекты, шпаргалки, учебники «ЭКСМО»b4455b31-6e46-102c-b0cc-edc40df1930e
- Год:2008
- Город:Москва
- ISBN:978-5-699-26007-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Наталья Бурханова - Теплотехника краткое содержание
Информативные ответы на все вопросы курса «Теплотехника» в соответствии с Государственным образовательным стандартом.
Теплотехника - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Если произвести замену удельных газовых постоянных R 1, R 2, …, R n их значениями из уравнения Клайперона, найдем среднюю молярную массу смеси газов, если смесь определяется массовыми долями:
M = 1 / (r 1 / M 1 + r 2 / M 2 +. + r n / M n).
В случае, когда смесь определяется объемными долями, получаем следующее выражение:
R = 1 / еr iR i = 8314,2 / еr iM i.
Зная, что R = 8314,2 / M, получим:
M = еr iM i = r 1M 1+ r 2M 2+. + r nM n.
Таким образом, средняя молярная масса смеси газовопределяется суммой произведений объемных долей на молярные массы отдельных газов, из которых состоит смесь.
29. Парциальные давления
Давление, записанное в виде: P i=N ikT / V,
где i = 1,2,..., r, называется парциальным.Здесь r – число газов в смеси;
N i – число молекул i-го газа;
V – объем смеси;
k – постоянная Больцмана;
Т – температура.
Оно может быть найдено, если все основные параметры газа известны:
P i= m iR iT / V =m iR i / mR = Pg iR i / R = Pg iM / M i
Если смесь задается объемными долями, то для получения парциального давления каждого газа обращаются к закону Бойля-Мариотта, из которого можно найти, что при Т = const:
P iV = PV i и P i= PV i / V = r iP.
Парциальное давлениелюбого газа вычисляется как произведение общего давления смеси газов на его объемную долю. Последнее уравнение используют при решении технических задач и при проверке тепловых установок. Объемные доли газов получают на опыте, используя газоанализаторы.
Физический смысл парциального давления Pi состоит в том, что это есть давление i-го газа при условии, что он занимал бы объем V.
Закон Дальтонаотражает зависимость между давлением смеси идеальных газов и их парциальными давлениями. Он гласит: давление смеси r идеальных газов и сумма их парциальных давлений равны между собой. Математическая формулировка закона Дальтона выглядит следующим образом:
Р = Р 1+ Р 2+ ...+ P r = NkT / V,
где N = N 1 + N 2 +... + N r – число молекул в смеси r газов.
Давление, которое оказывают молекулы каждого из r идеальных газов, не зависит от давления, оказываемого молекулами остальных газов. Причина такого явления заключается в том, что молекулы в идеальном газе не взаимодействуют. Было показано на опыте, что на высоких давлениях (порядка Ю 6Па) закон Дальтона не выполняется.
30. Закон сохранения и превращения энергии
Первый закон термодинамики основан на всеобщем законе сохранения и превращения энергии, который устанавливает, что энергия не создается и не исчезает.
Тела, участвующие в термодинамическом процессе, взаимодействуют друг с другом путем обмена энергией. При этом у однихтел энергия уменьшается, а у других – увеличивается. Существует два варианта передачи энергии физическими телами: теплообмен и совершение механической работы.
На практике единицей работы является также джоуль, количество работы обозначается L, удельная работа на единицу массы П кг) обозначается /.
Существует несколько основных положений первого закона термодинамики.
L Любые виды энергии не возникают сами по себе, а взаимно превращаются друг в друга, причем их количества всегда одинаковы.
2. Невозможно построить вечный двигатель первого рода.
3. Если система полностью изолирована, то ее внутренняя энергия остается постоянной.
Предположим, что Q – количество теплоты, подведенное к телу, которое необходимо затратить на осуществление работы и на преобразование внутренней энергии:
Q = ΔU +L,
где L = ml – количество работы;
ДU = mДu– разность внутренней энергии начального и конечного состояния;
Q = mq.
В случае массы тела, равной 1 кг:
q = Δ u+l,
где l, q, Du – удельные количества работы, теплоты, разность внутренних энергий начального и конечного состояния. Если процесс бесконечно малый, то
dq = du + dl.
Полученное соотношение является математической моделью первого закона термодинамики.Отсюда следует такая формулировка закона: «Все количество теплоты, которое получает физическое тело, тратится на выполнение работы и на преобразование внутренней энергии тела».
Существует так называемое правило знаков для параметров: q > 0, если теплота подводится к физическому телу, и q <0, если отводится; l > 0, если работа совершается самим телом (расширение), и l < 0, если работу совершают над телом извне (сжатие); D u > 0 – если внутренняя энергия тела увеличивается, D u < 0 – если внутренняя энергия уменьшается.
31. Внутренняя энергия
Внутренняя энергияскладывается из внутренних кинетической и потенциальной энергий. Внутренняя кинетическая энергия создается хаотическим движением молекул вещества.
Кинетическая энергия всей макросистемы вычисляется:
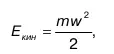
где m – масса системы;
w – скорость ее движения в пространстве.
Силы взаимодействия молекул вещества друг с другом определяют внутреннюю потенциальную энергию тела.
Внутренней энергиейназывается такая энергия, которая заключена в самой системе и имеет две составляющие – кинетическую энергию.
Изменение удельной потенциальной (внутренней) энергии того же тела. Изменение всей удельной (внутренней) энергии при термодинамическом процессе будет выглядеть так:
Δu – U k – и р.
Внутренняя энергия рабочего тела произвольной массы при этом рассчитывается по формуле:
Δv-V k– V p.
Предположим, что рабочее тело переходит из первого состояния во второе при подводе теплоты извне. Тогда количество этой теплоты выразится в виде:
q 1, 2– u 2- U 1.
Процесс проходит по изохорному закону, имеем:
q 1,2= ć v (T 2-T 1).
В общем виде для любого вещества массой m:
v 2-v 1– mć v(T 2– T 1),
где T 1– начальная температура термодинамического процесса;
T 2 – конечная температура;
u 1– начальная величина внутренней энергии;
u 2– конечная величина внутренней энергии;
ć– средняя удельная теплоемкость (изохорная).
32. Вычисление работы газа
Газ получает теплоту от определенного источника вне системы. обозначим давление газа буквой р, площадь поршня – S, тогда под действием внешней силы F = pS на поршень он будет неподвижен. При уменьшении внешней силы F разность этих двух сил pS – F сместит поршень вправо. Газ под поршнем будет расширяться и преодолевать внешние силы, совершая при этом работу. При равновесном процессе имеем следующее.
Читать дальшеИнтервал:
Закладка:










