Наталья Бурханова - Теплотехника
- Название:Теплотехника
- Автор:
- Жанр:
- Издательство:Конспекты, шпаргалки, учебники «ЭКСМО»b4455b31-6e46-102c-b0cc-edc40df1930e
- Год:2008
- Город:Москва
- ISBN:978-5-699-26007-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Наталья Бурханова - Теплотехника краткое содержание
Информативные ответы на все вопросы курса «Теплотехника» в соответствии с Государственным образовательным стандартом.
Теплотехника - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
38. Изменение энтропии в процессах
Энтропиейназывается параметр состояния, который зависит от приведенной теплоты (отношение q / T). Изменение энтропии вычисляется по формуле:
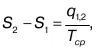
где q 1,2количество теплоты, подведенной к рабочему телу или отведенной от него;
T ср– средняя температура подведенной (или отведенной) теплоты.
Это соотношение определяет изменение энтропии от начального значения энтропии S 1до конечного значения S 2
1) при q 1,2> 0 (теплота подводится к рабочему телу) изменение энтропии положительно: S 2– S 1> 0, S 2> S 1, так как средняя термодинамическая температура должна быть всегда положительной, т. е. T ср > 0. Иными словами, энтропия тела возрастает;
2) при q 1,2< 0 (теплота отводится от рабочего тела) изменение энтропии отрицательно: S 2– S 1<0, S 2< S 1т. е. энтропия тела снижается;
3) при q 1,2= 0 (адиабатический процесс) изменение энтропии равно нулю: S 2– S 1= 0, S 2= S 1т. е. энтропия тела остается постоянной. Процесс, в ходе которого значение энтропии не меняется, называется изоэнтропийным.
Для идеального газа получаем следующие выводы.
1. При изотермическом процессе вместо T срдостаточно в уравнение энтропии подставлять значения температуры Т, так как T 1= T 2= const.
2. Изменение энтропии при изохорном процессе равно:
S 2– S 1= 2,3mć vlg(T 2/ T 1).
3. Изменение энтропии при изобарном процессе равно:
S 2– S 1= 2,3mć plg(T 2/ T 1).
где ć V– удельная теплоемкость в процессе с постоянным объемом;
ć p – удельная теплоемкость в процессе с постоянным давлением.
Таким образом, энтропия может увеличиваться (уменьшаться) при подведении (отведении) теплоты к произвольно взятому рабочему телу либо оставаться неизменной в случае отсутствия теплообмена. При совершении цикла энтропия рабочего тела также увеличиваетсяпри получении теплоты от источника либо уменьшается при отдаче теплоты источнику.
В реальныхпроцессах вследствие явления необратимости работоспособность теплового устройства снижается. Мерой таких потерь является энтропия: ее возрастание прямо зависит от потери количества работы.
39. Принцип возрастания энтропии и физический смысл второго закона термодинамики
Исследуем понятие энтропии как функции состояния:
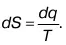
Второй закон термодинамикиможно сформу лировать в виде: Величина энтропии
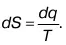
представляет собой полный диффереренциал, т. е. является функцией состояния.
Одним из физических смыслов энтропии можно назвать увеличение организованности (упорядоченности) системы при уменьшении энтропии.
Рассмотрим явление возрастания энтропии на примере замкнутой изолированной системы, состоящей из рабочего тела, горячего и холодного источников теплоты, образующих среду системы. Переход системы из одного положения в другое сопровождается работой, причем
dS ≥ 0,S 2> S 1.
Для изолированной замкнутой системы изменение (приращение) энтропии положительно (необратимый процесс) либо равно нулю (обратимый процесс) для произвольного термодинамического процесса.
Для циклического процесса преобразования теплоты в работу (несамопроизвольного) SdS i= 0 (обратимые процессы) и SdS > 0 (необратимые процессы), следовательно, в изолированной системе энтропия возрастает.
Это утверждение называется принципом возрастания энтропии.
Математическое выражение второго закона термодинамики в дифференциальном виде записывается так:
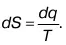
где знак равенства применяется для обратимого процесса, а неравенства – для необратимого.
Из этого уравнения видно, что общее приращение энтропии зависит от температуры. Известно, что при повышении температуры рабочего тела повышается количество теплоты, которое можно преобразовать в работу. Иначе говоря, энергетическая ценность теплоты возрастает. Таким образом, энтропия через температуру определяет количество теплоты, переведенное в работу, что устанавливает ее связь со вторым законом термодинамики. В этом законе определяются условия преобразования теплоты в полезную работу.
Эксэргетическими функцияминазываются выражения, позволяющие вычислять величину эксэргии.
40. Энтропия и статический характер второго закона термодинамики
Известно, что в теории механики для изучения движения отдельных молекул применяются динамические закономерности. Молекулярно-кинетическая теория отличается от механики тем, что изучает системы, состоящие из большого количества молекул. Хаотическое движение частиц в таких системах подчиняется другим (статистическим) законам. Несмотря на то что движение каждой молекулы описывается механическими законами, вся совокупность частиц не рассматривается в теории механики, ее поведение изучается статистической физикой. Дело в том, что для всех частиц устанавливается среднее значение их характеристик – средняя скорость, среднее значение энергии и др. (средняя температура, среднее давление).
При таких статистических условиях усреднение характеристик существования любого термодинамического состояния вещества (например, газа) не является строго обязательным, а только имеет некоторую вероятность.
Самым простым примером является случай равенства скоростей всех молекул газа как наименьшая вероятность существования состояния данного вещества. Обозначим условно такую вероятность значением величины В случае неодинаковых скоростей возможное число их комбинаций велико, и существование состояния, при котором скорости частиц не равны, имеет вероятность W > W 0, причем это отличие довольно значительно. Таким образом, термодинамической вероятностьюназывается величина:
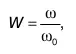
ее значение намного больше единицы, в связи с чем ее также называют статистическим весом термодинамического состояния. Статистическая физика также устанавливает связь термодинамической вероятности с энтропиейсистемы.
Прямая зависимость энтропии от логарифма термодинамической вероятности определяется выражением:
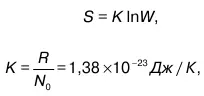
где R – постоянная Клайперона;
N 0– постоянная Авогадро.
Величина K является константой (или постоянной) Больцмана.
Следовательно, с увеличением энтропии увеличивается вероятность наступления того или иного термодинамического состояния. Причем наиболее вероятное состояние наступает при максимальном значении энтропии.
Читать дальшеИнтервал:
Закладка:










