Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Название:Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1980
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи краткое содержание
Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
4) если число найденных 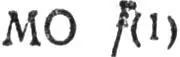 и
и 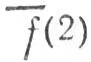 в сумме отлично от числа всех занятых канонических МО, аналогичным образом определяются многоцентровые
в сумме отлично от числа всех занятых канонических МО, аналогичным образом определяются многоцентровые 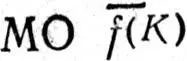 последовательно для К = 3, 4,..., пока число локализованных МО не сравняется с числом занятых канонических МО.
последовательно для К = 3, 4,..., пока число локализованных МО не сравняется с числом занятых канонических МО.

Таблица 6. Одноэлектронная матрица плотности для молекулы метана, представленная в ортогонализованном (по Лёвдину) базису АО
Следует отметить, однако, что такую последовательность построения локализованных МО не всегда можно считать оправданной. Например, нет оснований для поиска локализованных трехцентровых МО диборана в подпространстве занятых МО, более узком, чем рассматриваемое при построении двухцентровых МО этой молекулы.
Существенным недостатком метода проектирования является то, что он приводит к неортогональным наборам локализованных МО. В частности, орбиталь h а, принадлежащая атому А и перекрывающаяся с орбиталью h b, атома В, принадлежит отчасти и последнему атому, а перекрывание МО 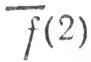 l, локализованной на связи АВ, и МО
l, локализованной на связи АВ, и МО 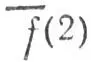 lлокализованной на связи АС, означает, что
lлокализованной на связи АС, означает, что 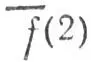 lи
lи 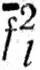 делокализованы на связи АС и АВ соответственно. В работах [73, 74] предлагалось ортогонализовывать наборы
делокализованы на связи АС и АВ соответственно. В работах [73, 74] предлагалось ортогонализовывать наборы 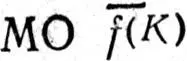 по методу Лёвдина [62]. Однако локализация получаемых таким образом МО не будет оптимальной в смысле максимума проекционной нормы
по методу Лёвдина [62]. Однако локализация получаемых таким образом МО не будет оптимальной в смысле максимума проекционной нормы 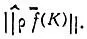 . Поэтому метод проектирования удобно применять в тех случаях, когда требуется выделить лишь одну локализованную МО, например МО, реализующую донорно-акцепторную связь в аддукте Н 3В. NH 3.
. Поэтому метод проектирования удобно применять в тех случаях, когда требуется выделить лишь одну локализованную МО, например МО, реализующую донорно-акцепторную связь в аддукте Н 3В. NH 3.
Представляется разумным формулировать метод проектирования в ортогонализованном по Лёвдину многоцентровом базисе АО, орбитали которого могут рассматриваться как "модифицированные АО", представляющие атомы в химическом соединении. К такому базису относятся фактически результаты полуэмпирических расчетов МО в приближении полного пренебрежения дифференциальным перекрыванием. Следует отметить, что ортогонализация многоцентрового базиса АО gобеспечивает ортогональность гибридных АО неподеленных электронных пар, но двухцентровые или многоцентровые локализованные МО, определяемые методом проектирования, остаются при этом неортогональными, если связиi на которых они локализованы, имеют общие атомы.
Рассмотрим теперь в качестве примера, иллюстрирующего метод проектирования, данные по локализации МО и гибридизации АО в молекуле метана, полученные нами на основе расчетов в приближении полного пренебрежения дифференциальным перекрыванием. В табл. 6 приведена одноэлектронная матрица плотности Рдля молекулы метана, равновесная геометрия и ориентация в пространстве которой определяются данными табл. 7. Вычислим двухцентровую МО, локализованную на связи С-H 1. Для этого выделим из матрицы Рблок, соответствующий орбиталям атома углерода и атома водорода H 1:

и приведем его унитарным преобразованием к диагональному виду
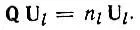 (4.44)
(4.44)

Таблица 7. Декартовы координаты атомов в молекуле метана,А о
Собственные значения n lравны 2,000; 1,150; 1,009; 1,009; 0,000. Таким образом, одна из одноцентровых орбиталей, представленная в базисе АО
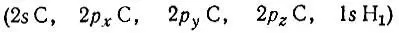
столбцом

оказывается естественной МО, строго локализованной на связи С-Н 1и заселенной двумя электронами. Эту локализованную МО можно записать в виде следующей линейной комбинации базисных атомных орбиталей:
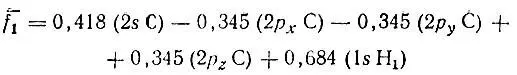
или
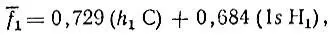
где
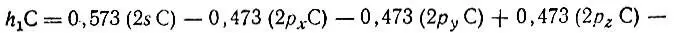
гибридная АО углерода, ориентированная вдоль связи С-Н 1, Существенно, что s-характер этой гибридной орбитали равен 33%, что соответствует sр 2-гибридизации атома углерода и явно противоречит распространенному в химической литературе мнению о sp 3-гибридизации углерода в метане и других насыщенных соединениях. Такое противоречие является следствием того что метод проектирования приводит к неортогональным наборам локализованных МО и гибридных АО, в то время как в теоретической химии обычно используется понятие об ортогональных орбиталях. Ортогонализация неортогонального набора четыоех эквивалентных гибридных АО h iC по методу Лёвдина приводит в рассматриваемом случае (СН 4) к четырем ортогональным эквивалентным гибридным АО, которые идентичны гибридным АО углерода в метане, полученным из соображений симметрии. Вместе с тем следует отметить, что завышенный s-характер неортогональных гибридных АО углерода не является случайным. Как повышенная заселенность 2s-орбитали углерода в метане (1,2 против 1,0 для каждой из 2р-орбиталеЙ) он отражает "энергетическую предпочтительность" 2s-орбитали углерода по сравнению с его 2р-орбиталыо. В связи с этим уместно привести потенциалы ионизации свободного, т. е. химически не связанного, атома углерода, соответствующие его валентным орбиталям. Для 2s 22p 2-конфигурации I 2s= 16,6 эВ и I 2p= 12 4 эВ; для 2s2p 3-конфигурации I 2s= 24,7 эВ и I 2p= 12,4 эВ.
Читать дальшеИнтервал:
Закладка:









