Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Название:Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1980
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи краткое содержание
Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
соответствует виртуальная разрыхляющая
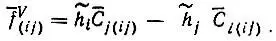 (4.52)
(4.52)
Остальные локализованные виртуальные МО являются просто вакантными гибридными АО.
Если исходный набор МО
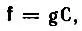 (4.53)
(4.53)
включающий и виртуальные МО, преобразуется в набор 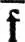 строго локализованных МО (также включающий виртуальные МО) преобразованием
строго локализованных МО (также включающий виртуальные МО) преобразованием
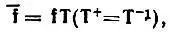 (4.54)
(4.54)
то матрица Т, осуществляющая строгую локализацию исходных МО f, определяется как
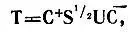 (4.55)
(4.55)
где
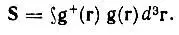
В рассматриваемом примере (HCN) гибридные АО выражаются через исходные сферические АО согласно следующим равенствам:

Из этих выражений видно, что в приближении строгой локализации МО гибридные АО h 1C и h 1N являются орбиталями электронных пар остова, h 3N-ГAO представляет неподеленную электронную пару азота, остальные ГАО образуют МО σ-типа, локализованные на связях НС и CN. Степень локализации МО характеризуется среднеквадратическим отклонением матрицы плотности Р hот эталонной 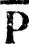 :
:
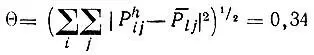 (4.56)
(4.56)
и удвоенной суммой квадратов интегралов перекрывания строго локализованных 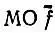 с исходными f:
с исходными f:
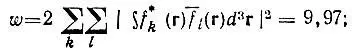 (4.57)
(4.57)
ω не может превосходить числа электронов N (в рассматриваемой системе ω< 10), и локализация будет тем точнее, чем ближе значения ω и N.
Метод эталонной матрицы плотности обобщается для случаев, когда необходимо учитывать полярность локализованных двухцентровых МО. Такое обобщение можно осуществить при замене в эталонной матрице плотности блоков
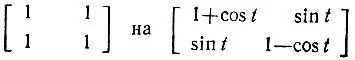
и при определении параметров поляризации t вариационным методом [63]. Строго ковалентным связывающим МО при этом будет соответствовать значение t = π/ 2, а неподеленным электронным парам и вакантным ГАО — t = 0 или π. Строго говоря, такое обобщение рассматриваемого метода уже не позволяет называть его методом эталонной матрицы плотности. Легко убедиться, однако, что учет полярности связей, как правило, возможен и с фиксированной эталонной матрицей  , т. е. результаты ее вариационного определения могут быть предсказаны заранее. При этом для ГАО неподеленных электронных пар (h l)
, т. е. результаты ее вариационного определения могут быть предсказаны заранее. При этом для ГАО неподеленных электронных пар (h l)  ll= 2, Для вакантных ГАО (h i)
ll= 2, Для вакантных ГАО (h i)  ii= 0, а для валентных ГАО h aи h b, образующих локализованную
ii= 0, а для валентных ГАО h aи h b, образующих локализованную 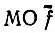 ab, эталонные заселенности
ab, эталонные заселенности  aa,
aa, 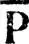 bbи порядки связей
bbи порядки связей 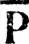 abопределяются равенствами
abопределяются равенствами
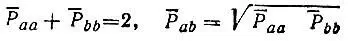
и условием инвариантности атомных зарядов относительно гибридизации АО.
Коэффициенты разложения строго локализованных МО по ортогонализованным ГАО выражаются через их заселенности по формулам

Для молекулы HCN заселенность 1s-орбитали водорода равна 0,855 и, следовательно, заселенность гибридной АО углерода h 2C равна 1,145. Так как сумма заселенностей всех σ-орбиталей углерода составляет 4,099, заселенность его h 3С-ГАО равна 0,954. Определяя теперь порядки связей (недиагональные элементы матрицы Р) как среднегеометрические значения соответствующих заселенностей (диагональных элементов матрицы  ), получаем
), получаем
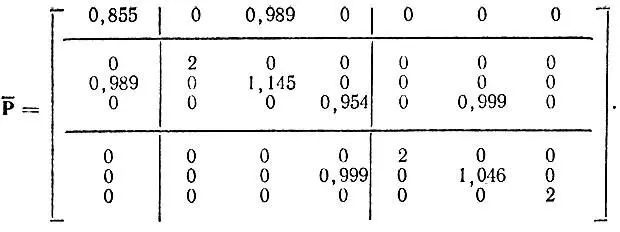
Вычисления свидетельствуют, что при учете полярности локализованных МО матрица Р hостается практически неизменной. Коэффициенты гибридизации также почти не меняются. В то же время максимум ω повышается до 9,98 (w ≈ 10), а минимум θ понижается до 0,25. Таким образом, учет полярности локализованных МО заметно улучшает аппроксимацию "точной" матрицы плотности Р hэталонной матрицей  , хотя и является несущественным для определения характера гибридизации АО.
, хотя и является несущественным для определения характера гибридизации АО.
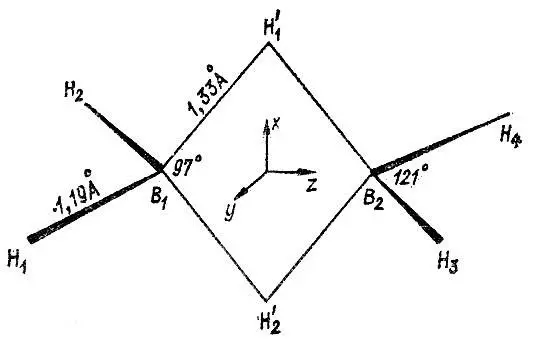
Метод эталонной матрицы плотности допускает обобщение на системы с многоцентровыми связями [22]. Типичным примером химического соединения ОМ, которого нельзя локализовать исключительно в одноцентровые и двухцентровые МО, является молекула диборана В 2Н 6(рис. 19). Два из шести атомов водорода в этой молекуле имеют по два равноотстоящих соседних атома (B 1и В 2). Каждый из атомов бора, в свою очередь, связан с четырьмя атомами водорода. Следует учитывать также возможность непосредственного химического взаимодействия атомов бора друг с другом.
Интервал:
Закладка:









