Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Название:Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1980
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи краткое содержание
Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Рис. 19. Молекула диборана
"Внешние" связи ВН в диборане, очевидно, реализуются двухцентровыми МО, образуемыми 1s-орбиталями водорода и гибридными АО бора. Еще не зная конкретного вида этих ГАО (h), можно определить их заселенности 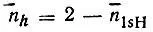 по известным заселенностям
по известным заселенностям  =n 1sH. Предположим далее, что две другие валентные МО локализуются на трехцентровых связях B 1H 1'B 2и B 1H 2'B 2и что каждая из них образована 1sH' iорбиталью водорода и гибридными АО бора h i1' и h i2' причем
=n 1sH. Предположим далее, что две другие валентные МО локализуются на трехцентровых связях B 1H 1'B 2и B 1H 2'B 2и что каждая из них образована 1sH' iорбиталью водорода и гибридными АО бора h i1' и h i2' причем

Таким образом определяются диагональные элементы эталонной матрицы плотности (  ). Недиагональные элементы
). Недиагональные элементы  ab, как было показано в работе [22], могут быть вычислены как геометрические средние значения диагональных элементов независимо от того, каким связям (двухцентровым или трехцентровым) они соответствуют.
ab, как было показано в работе [22], могут быть вычислены как геометрические средние значения диагональных элементов независимо от того, каким связям (двухцентровым или трехцентровым) они соответствуют.
Росле того как построена матрица  , максимизацией ω(4.57) вычисляются оптимальные ГАО бора В 1:
, максимизацией ω(4.57) вычисляются оптимальные ГАО бора В 1:
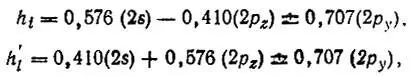
и ГАО атома В 2, отличающиеся от указанных лишь знаком коэффициента при 2p z-орбитали.
Гибридные АО бора h 1и h 2, ориентированные к периферийным атомам водорода H 1и Н 2, образуют угол 120°; угол h' j-орбиталями, ориентированными к мостиковым атомам водорода H' j, существенно меньше и составляет 102° (ср. с углами на рис.19).
Интересный елучай представляет молекула циклопропана, особенностью которой, отличающей ее от молекул большинства других органических соединений, является аномально-малый угол между связями С-С. Три атома углерода в циклопропане образуют правильный треугольник с углами в 60°, что существенно меньше обычных значений 109,5° для насыщенных и 120° для сопряженных ненасыщенных соединений (рис. 20).

Рис. 20. Молекула циклопропана
Для описания структуры химической связи в циклопропане были предложены две модели. Согласно модели Коулсона и Моффита [36], в циклопропане реализуются три локализованные двухцентровые двухэлектронные связи углерод-углерод. Образующие эти связи гибридные АО ориентированы навстречу друг другу, но не строго по линии С-С, а под некоторым углом к ней (рис. 21). Из условия ортогональности вещественных гибридных АО следует, что этот угол не может быть меньше 15°. Особые химические свойства циклопропана, близкие к свойствам алкенов (хотя он относится к насыщенным углеводородам), объясняются в рамках модели Коулсона и Моффита тем, что "банановые" МО циклопропана подобны эквивалентным банановым МО, которые получают — π-типа в алкенах.

Рис. 21. Модель Коулсона и Моффита для молекулы циклопропана
Согласно модели Уолша [84], в циклопропане реализуются две трехцентровые межуглеродные связи, одна — двухэлектронная, а другая — четырехэлектронная (рис. 22). Двухэлектронной связи соответствует полносимметричная трехцентровая МО, четырехэлектронной — две вырожденные МО, образованные "чистыми" 2р-орбиталями углерода и преобразующиеся по двумерному неприводимому представлению группы симметрии молекулы D 3h).
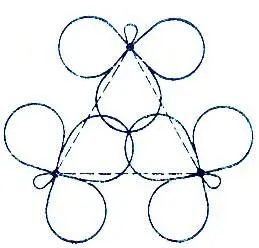
Рис. 22. Модель Уолша для молекулы циклопропана
Метод эталонной матрицы плотности позволяет сравнить качество альтернативных моделей и вычислить отвечающие им коэффициенты гибридизации АО углерода. Вычисленный s-xaрактер ГАО, реализующих двухцентровые углерод-углеродные связи в модели Коулсона и Моффита, χ s= 18%, и вычисленное значение угла между этими ГАО (принадлежащими общему атому углерода) равно 102°, что означает их отклонение на 21° от линии, связывающей атомные ядра. Гибридные АО, реализующие трехцентровые двухэлектронные связи в модели Уолша, определяются значением χ s= 35% и ориентацией к центру молекулы циклопропана. Наконец, гибридные АО, реализующие углерод-водородные связи, как свидетельствуют вычисления, почти не зависят от выбора модели и ориентированы вдоль линии С-Н.
Погрешности, вносимые в одноэлектронную матрицу плотности молекулы циклопропана локализацией МО, характеризуются величинами:

Таким образом, модель Коулсона-Моффита, предполагающая более высокую степень локализации МО, не уступает по точности модели Уолша и даже несколько превосходит ее. Однако различие в точности рассматриваемых моделей достаточно мало, и ни одну из них нельзя считать ошибочной.
Анализ заселенности атомных орбиталей
[23]
В квантовой химии функции Ψ, описывающие состояния многоэлектронных систем, обычно выражаются через АО или подобные им более элементарные функции, центрированные на различных ядрах молекулы. Такой выбор одноэлектронного базиса {φ} основан на предположении, что атом, представленный определенным набором орбиталей в таком базисе, сохраняет в молекуле свою индивидуальность. В связи с этим встает задача построения формализма, позволяющего характеризовать состояния химически связанных атомов и установить корреляции между этими состояниями и состояниями невзаимодействующих атомов.
Анализ заселенностей орбиталей, представляющих атом в молекуле, в значительной степени определяет его валентное состояние и является Эффективным средством исследования природы химической связи, ее анатомии, аддитивности и трансферабельности связанных с атомами молекулярных свойств или их зависимости от окружения рассматриваемого атома в различных соединениях. Анализ заселенностей АО позволяет осуществить выбор базисных функций, соответствующих валентным состояниям атомов, и необходим при расчете электронной структуры молекул и кристаллов полуэмпирическими методами с самосогласованием по формальным зарядам и валентным конфигурациям
Читать дальшеИнтервал:
Закладка:









